|
ПОТЕНЦИАЛ ИОНИЗАЦИИ
частицы (молекулы, атома, иона), минимальная разность потенциалов U, к-рую
должен пройти электрон в ускоряющем электрич. поле, чтобы приобрести кинетич.
энергию, достаточную для ионизации частицы. П. и. частицы X с образованием частицы
X' соответствует процессу:
X + е : X' + 2е.
Более общее понятие-энергия
ионизации Е, миним. энергия, необходимая для удаления электрона из частицы
на бесконечность. Она связана с П. и. соотношением:
E=Ue,
где е-элементарный
электрич. заряд. Энергия ионизации является св-вом частицы и не зависит от способа
удаления электрона, тогда как П. и., строго говоря, лишь характеристика исторически
первого метода ионизации электронным ударом (см. Ионы в газах). Энергия
ионизации, выраженная в эВ, численно совпадает с П. и., выраженным в В.
Различают первый, второй
и т.д. П.и., соответствующие удалению из частицы первого, второго и т.д. электронов.
Второй П. и. нейтральной частицы X совпадает с первым П.и. иона Х+
и т.д. Первый П.и. отрицат. иона Х-совпадает со сродством к электрону
частицы X.
Для атомов понятия первого,
второго и т. д. П. и. относят к ионизации невозбужденного атома с образованием
невозбужденного положит. иона. Для молекул различают адиабатический П. и. и
вертикальные П. и. Адиабатический П. и. отвечает процессу, при к-ром из молекулы,
находящейся в основном состоянии, в результате ионизации образуется положит.
мол. ион также в основном состоянии. Вертикальные П.и. характеризуют ионизацию
молекул, при к-рой образующийся мол. ион может находитья в произвольном энергетич.
состоянии (электронном и колебательном), причем соответствующие квантовые
переходы происходят без изменения межъядерных расстояний (рис. 1).
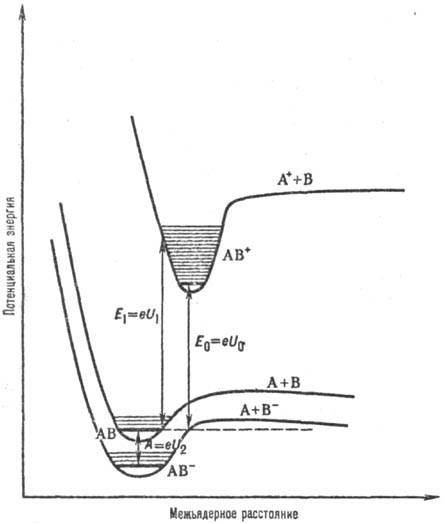
Рис. 1. Кривые потенц.
энергии для основных электронных состояний молекулы АВ и ионов АВ+
и АВ-. U0 - первый адиабатам, потенциал ионизации
молекулы АВ (E0-энергия ионизации); U1-
первый вертикальный потенциал ионизации молекулы АВ (Е1-
соответствующая энергия ионизации), A-адиаба-тич. сродство к электрону
молекулы АВ (U2-адиабатич. потенциал ионизации иона АВ-).
Возможно термодинамич.
определение П. и. атомов и адиабатического П. и. молекул через стандартную энтальпию
DH0 р-ции X Х+
+ е при абс. нуле т-ры: Х+
+ е при абс. нуле т-ры:
DH0
= NAE = NAUe,
где NA-постоянная
Авогадро.
Первые П. и. известны для
атомов всех элементов перио-дич. системы и нсск. тыс. молекул. У легких атомов
с зарядом ядра Z < 10-15, как правило, надежно определены все П.и. (первый,
второй и т.д. до Z); у более тяжелых атомов-неск. начальных П. и. В изменении
первых П. и. атомов явно выражена периодичность при увеличении Z. При
движении слева направо по периоду П. и., вообще говоря, постепенно увеличивается;
при увеличении Z в пределах подгруппы П. и. уменьшается (рис. 2).
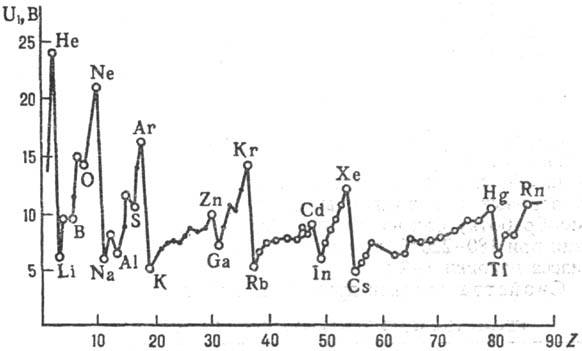
Рис. 2. Зависимость первых
потенциалов ионизации U1 атомов хим. элементов от атомного
номера Z.
Осн. совр. методы определения
П. и.: фотоэлектронная спектроскопия, фотоионизация, изучение ионно-молекулярных
реакций, поверхностная ионизация. Наилучшая точность определения П. и. атомов
и простейших молекул достигается при использовании спектроскопич. данных по
сходимости серий спектральных линий. Для сложных молекул предпочтительнее фотоэлектронная
спектроскопия (достигаемая точность до b0,001 эВ). Следует, однако, иметь
в виду, что этот метод в общем случае дает значения вертикальных, а не адиабатического
П. и. На П. и. атомов и атомных ионов оказывает влияние, помимо Z, экранирующий
эффект нижележащих электронных уровней. Минимальные первые П. и. имеют щелочные
металлы: Cs 2,893 В, Li 5,390 В; максимальные - благородные газы: Не 24,580
В, Rn 10,745 В. Известные П. и. молекул-это величины от 5 до 20 В (см. табл.).

В кон. 70-х гг. 20 в. обнаружены
т. наз. суперщелочи-молекулы с экстремально низкими значениями П. и.: ОК4
(3,62 В), ОК3 (3,65 В), ClNa2 (4,15 В) и др.
При переходе от валентных
электронов атома к остовным П. и. резко увеличивается. Так, для Be U1
9,320 В, U2 18,206 В, U3 153,850 В.
Квантовомех. расчеты П.
и. для атомов, двух- и трехатомных молекул дают значения, близкие по точности
к экспериментальным. Точность расчета в целом зависит от метода; так, для многоатомных
молекул в рамках метода мол. орбиталей она обычно не превышает 1 эВ (см. Купманса
теорема).
П. и. вместе со сродством
к электрону определяет величину электроотрицательности атомов и молекул.
Знание П. и. необходимо для расчетов термохим. процессов в иони-зир. газах и
плазме (газоразрядные приборы, магнитогид-родинамич. генераторы, процессы в
верх. слоях атмосферы и т.п.).
===
Исп. литература для статьи «ПОТЕНЦИАЛ ИОНИЗАЦИИ»: Энергии разрыва
химических связей. Потенциалы ионизации и сродство к электрону. Справочник,
под ред. В. Н. Кондратьева, М., 1974; Аллен К. У., Астрофизические величины,
пер. с англ., М., 1960; Степанов Н. Ф., Пу-пышев В. И., Квантовая механика молекул
и квантовая химия, М., 1991.
Страница «ПОТЕНЦИАЛ ИОНИЗАЦИИ» подготовлена по материалам химической энциклопедии.
|

