|
ПРОЛАМИНЫ, запасные
белки семян злаков (у пшеницы эти белки наз. птиалинами, у кукурузы-зеинами,
у ячменя-гордеинами, у ржи-секалинами, у овса-авснинами). П. делятся на две
группы-серосодержащие (S-богатые) и серо-несодержащие (S-бедные). Все эти белки
кодируются семействами родственных генов, имеющих общего предшественника. Часто
к П. относят также родственные им белки-глютенины (глутелины, или HMW). Все
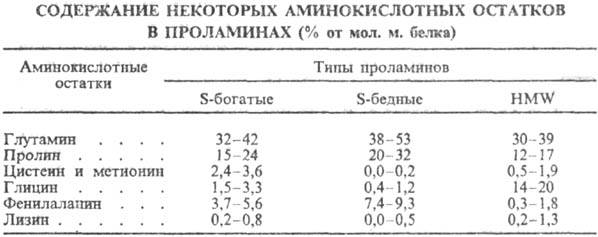
эти группы белков различаются по аминокислотному составу, содержат много остатков
глутамина и пролина, мало остатков основных аминокислот (см. табл.).
П. каждого злака содержат
большое кол-во разл. белков и экстрагируются из семян 70%-ным этанолом (это
послужило основанием Т. Б. Осборну в 1924 выделить эти белки в самостоят. группу).
Мол. м. S-богатых П. 20-40 тыс., они содержат внутримол. связи S—S. Мол. м.
S-бедных П. 45-80 тыс. Глютенины имеют мол. м. 94-145 тыс., с помощью связей
S—S они образуют гигантские ассоциаты, к-рые у пшеницы служат основой клейковинного
комплекса.
Молекулы S-богатых П. и
глютенинов имеют четко выраженную доменную организацию и состоят из уникальных
и повторяющихся последовательностей аминокислотных остатков. Более древние уникальные
последовательности у гордеинов имеют частичную гомологию с белковыми ингибиторами
трипсина, а повторяющиеся последовательности у П. всех злаков состоят из 7-12
аминокислотных остатков. Типичная повторяющаяся последовательность в глиадинах
-Pro—Gin—Gin—Pro—(Х)-(букв. обозначения см. в ст. Аминокислоты, X - остаток
одной из кодируемых аминокислот); она варьирует у разных П. при сохранении преобладающего
числа остатков глутамина и пролина. Кроме того, в молекулы П. включены также
участки из 4 и более остатков глутамина. Гетерогенность молекул П. в осн. обусловлена
варьированием числа повторяющихся последовательностей и модификацией в них аминокислотных
остатков.
Все предшественники П.
имеют сигнальный участок, состоящий из 16-20 аминокислотных остатков (первый
из них метионин), к-рый обеспечивает проникновение синтезируемой на полисомах
(комплекс молекулы матричной РНК с двумя или большим числом рибосом) молекулы
П. через мембрану эндоплазматич. ретикулума; затем этот участок отщепляется.
При электрофорезе в кислой
среде на крахмальном или полиакриламидном геле глиадины делятся по подвижности
на a-, b-, g- и w-группы, каждая из к-рых включает неск.
белков. Гордеины делятся на С и В группы. Причем малоподвижные белки группы
В-это S-бедные П. Глютенины при обычных условиях электрофореза остаются на старте.
При двухмерном электрофорезе глиадинов выделено более 50 компонентов, причем
разные сорта пшеницы существенно различаются по составу белков, относящихся
к П.
Установлена четкая взаимосвязь
между составом электро-форстич. компонентов П. и реологич. св-вами теста из
муки пшеницы, хлебопекарными достоинствами последней, а также качеством макарон.
Самое высокое содержание П. (без глютенинов) в суммарном белке пшеницы и ячменя
(40-50% по массе), самая низкая (10-15%)-у овса. У этой культуры отсутствуют
S-бедные П.
П. играют исключительно
важную роль при хлебопечении и произ-ве макаронных изделий. Предпринимаются
попытки с помощью генетич. инженерии модифицировать гены, кодирующие П., с целью
повышения в них содержания основных аминокислот (напр., лизина), т. к. бедность
белков злаков этими аминокислотами сильно снижает их биол. ценность.
===
Исп. литература для статьи «ПРОЛАМИНЫ»: Конарев В.
Г., Белки пшеницы, М., 1983; Созинов А. А., Полиморфизм белков и его значение
в генетике и селекции, М., 1985; Kasarda D. D. [а. о.], "Biochem. Biophys.
Acta", 1983, v. 747, № 1/2, p. 138-50; Payne P. I. [a.o.], "Theor.
Appl. Genet.", 1982, v. 63, № 2, p. 129-38; Кreis M. [a.o.], "Oxford
Surveys of Plant Molecular and Cell Biology", 1985, v. 2, p. 253-317.
А. А. Созинов.
Страница «ПРОЛАМИНЫ» подготовлена по материалам химической энциклопедии.
|

