|
АСИММЕТРИЧЕСКИЙ СИНТЕЗ, способ получения оптически активных
соед.; осуществляют с помощью р-ций, в результате к-рых в молекуле исходного
оптически неактивного соед. возникает хиральный элемент, гл. обр. асимметрический
атом углерода (отсюда название), при этом в продуктах р-ции оптич.
изомеры (энантиомеры) содержатся в неравных кол-вах. В кач-ве исходных
в-в используют прохиральные соед., т.е. такие, молекулы к-рых могут быть
превращены в хиральные при замене лишь одного атома или одной группы атомов.
Иногда под А.с. понимают возникновение нового хирального фрагмента в молекуле,
уже имеющей элемент хиральности (см. Стереоселективный синтез).
Достигается А. с. благодаря участию в нем асимметризующего агента, в
зависимости от типа к-рого различают частичный и абсолютный А.с. Первый
осуществляют с помощью вспомогат. оптически активных орг. в-в, второй -
под действием асимметрич. физ. фактора, напр. при использовании в р-циях
энантиоморфных кристаллов в кач-ве носителей катализаторов.
Эффективность А.с. оценивается оптич. выходом (в %), к-рый равен отношению
величины оптич. вращения продукта р-ции к величине оптич. вращения целевого
оптически чистого в-ва, или по энантиомерной чистоте. Последняя характеризует
состав оптически активного в-ва и равна (в %) 100(R - S)/(R + S),
где R и S - доли энантиомеров, определяемые с помощью газо-жидкостной
хроматографии, ЯМР-спектроскопии и др. методами.
Идею А. с. впервые высказал Э. Фишер в 1894, а первые синтезы осуществили
в нач. 20 в. В. Марквальд и А. Мак-Кензи. Оптич. выходы, однако, долгое
время оставались очень небольшими. Сейчас А. с. - реальный путь получения
оптически активных в-в.
Частичный асимметрический синтез. Обычно для проведения А. с.
осуществляют р-цию вспомогат. оптически активного в-ва с исходным прохиралъным
соед. либо со вторым компонентом р-ции - реагентом (напр., магнийорг. соед.),
в результате чего хиральный фрагмент молекулы вспомогат. в-ва входит соотв.
в молекулу исходного соед. или реагента. Если хиральный фрагмент молекулы
вспомогат. в-ва войдет в состав исходного прохирального соед., то в результате
А. с. образуются неравные кол-ва диастереомеров (диастереоселективный синтез),
т.к. молекулы полученного соед. будут содержать два хиральных элемента.
Для получения оптич. изомера проводят отщепление хирального фрагмента молекулы
вспомогат. в-ва от молекул диастереомеров. Будучи введенным в молекулу
реагента, хиральный фрагмент молекулы вспомогат. в-ва может и не войти
в состав продукта р-ции, а лишь содействовать образованию избытка одного
из энантиомеров. Такой А. с. называют энантиоселективным. Осуществлены
и др. виды энантиоселективных синтезов - превращения в присут. оптически
активных р-рителей, а также гомог. и гетерог. катализаторов (асимметрич.
катализ).
Объяснение механизма частичного А. с. основано на представлении о возможности
образования диастереомерных переходных состояний с разл. энергиями. Р-ция
направляется преим. по энергетически более выгодному пути. При этом для
получения высокого оптич. выхода достаточно небольших различий в энергиях
переходных состояний. Так, если разница между энергиями составляет ок.
11 кДж/моль, оптич. выход достигает 98%.
А.с. оптически активных спиртов часто осуществляют восстановлением карбонильных
соед. с помощью хиральных комплексов, образующихся при взаимод. Li[AlH4]
или Na[BH4] с оптически активными диаминами, аминоспиртами,
диолами, углеводами [напр., с N-метилэфедрином, 1,4-бис-(диметиламино)-2,3-бутандиолом].
Так, алюмогидридный комплекс ( — )-N-метилэфедрина и N-этиланилина восстанавливает
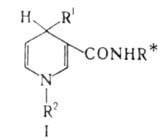
карбонильную группу бензальацетона с оптич. выходом до 98%. Действием дигидропиридиновых
реагентов (ф-ла I, R1-H или СН3, R2 -
алкил; звездочкой обозначен хиральный радикал) осуществлены эффективные
асимметрич. р-ции восстановления кетогрупп. Высокие оптич. выходы достигаются
при восстановлении карбонильных групп оптически активными пространственно
затрудненными магнийорг. соед., напр.:
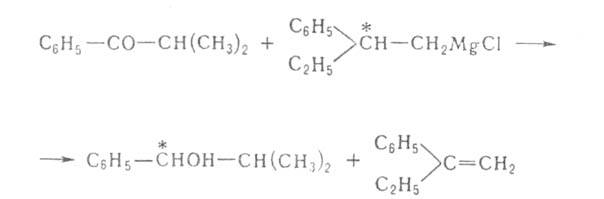
Эффективное асимметрич. превращ. карбонильных соед. во вторичные или
третичные спирты при действии металлоорг. соед. достигается также, когда
хиральный остаток вспомогат. оптически активного в-ва входит в состав субстрата
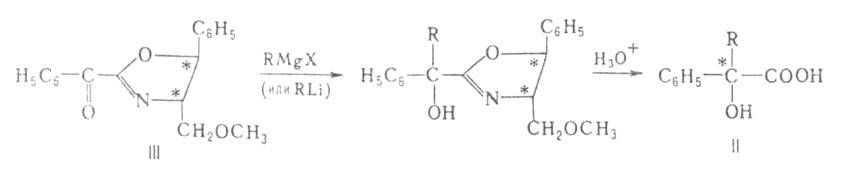
или р-рителя. Так, разработан синтез (с оптич. выходом до 87%)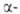 гидроксикислот
(II) действием магний- или литийорг. соед. на субстраты, в к-рых группа
С=О находится в молекуле оптически активного оксазолипового производного
(III): гидроксикислот
(II) действием магний- или литийорг. соед. на субстраты, в к-рых группа
С=О находится в молекуле оптически активного оксазолипового производного
(III):
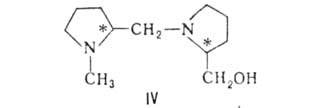
При взаимод. бутиллития с бензальдегидом в присут. хиральной добавки
- пролинового производного ф-лы IV получают бутилфенилкарбинол с оптич.
выходом 95%.
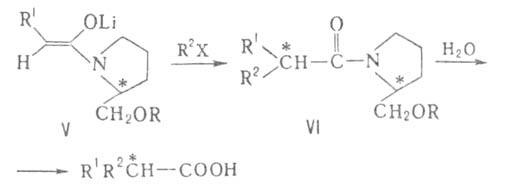
При алкилировании хиральных енолятов (V) и послед. гидролизе диастереомера
(VI) образуются к-ты с оптич. выходом до 90%.
Высокие оптич. выходы достигаются и в др. р-циях карбонильных соед.,
напр. при альдолъной и кретоновой конденсации. Широко используют в А. с.
азометины, енамины, енгидразины, напр.:
Вспомогат. хиральными агентами в этих синтезах служат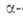 фенилэтиламин
и нек-рые др. амины, а также производные пролина; оптич. выход до 98%. фенилэтиламин
и нек-рые др. амины, а также производные пролина; оптич. выход до 98%.
Превращ. карбонильной группы подчиняются правилам Прелога и Крама. Правило
Прелога связывает конфигурацию вспомогат. оптически активного в-ва - спирта,
используемого для получения сложных эфиров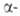 кетокислот,
с преимущественной конфигурацией хирального центра, образующегося при диастереоселективных
р-циях указанных эфиров (VII) с металлоорг. соед. или при восстановлении
: кетокислот,
с преимущественной конфигурацией хирального центра, образующегося при диастереоселективных
р-циях указанных эфиров (VII) с металлоорг. соед. или при восстановлении
:
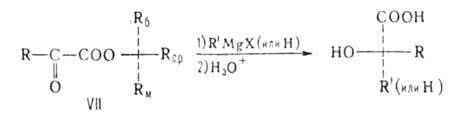
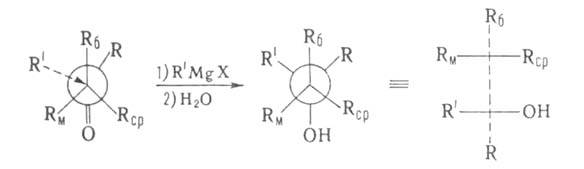
В молекуле вспомогательного вещества (оптически активного спирта) Rб,
Rcp и Rм -соответственно большой, средний и малый
радикалы. Истолкование правила основано на допущении, что молекула эфира
имеет плоскую, конформацию с трансоидным расположением групп С=О, Rм
заслоняет кетогруппу, a Rб и Rср не лежат в плоскости
молекулы:
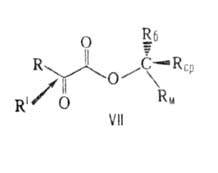
В соответствии с правилом Прелога конфигурация образующегося асимметрии,
центра определяется направлением подхода к нему заместителя R', к-рый осуществляется
со стороны Rср- меньшего из радикалов, не лежащих в плоскости
молекулы. Правило предложено В. Прелогом в 1953.
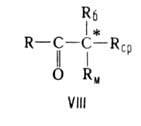
Правило Крама связывает преимущественную конфигурацию асимметрии, центра,
образующегося при диастереоселективных р-циях кетонов ф-лы VIII, с конфигурацией
уже имеющегося в молекуле кетона асимметрии, центра. Кетон реагирует в
конформации с трансоидным расположением Rб и группы С=О:
В соответствии с правилом Крама подход заместителя R', как и в слуиае
правила Прелога, осуществляется со стороны меньшего из заместителей Rм.
Правило Крама применяют для корреляции конфигураций спиртов, образующихся
при восстановлении кетонов комплексными гидридами металлов, щелоиными металлами,
амальгамой Na, а также при р-циях кетонов с металлоорг. соединениями. Правило
предложено Д. Крамом в 1952.
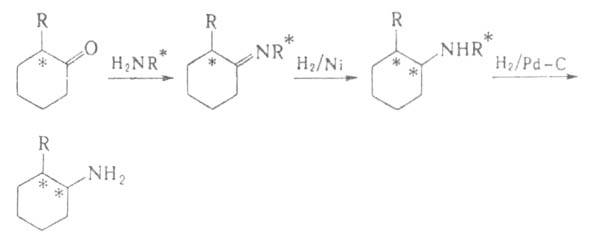
Разработан ряд А.с.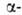 аминокислот,
напр. из альдегидов по р-ции Зелинского - Штреккера (с использованием оптически
активного амина вместо NH3) или из хиральных дикетопиперазинов
(синтезированных из глицина и хиральных аминокислот): аминокислот,
напр. из альдегидов по р-ции Зелинского - Штреккера (с использованием оптически
активного амина вместо NH3) или из хиральных дикетопиперазинов
(синтезированных из глицина и хиральных аминокислот):
С помощью А. с. осуществлены разнообразные р-ции присоединения по связям
С=С, напр. р-ция Михаэля, диеновый синтез, аминопалладирование, присоединение
литийкупратов LiCuR2. Высокие оптич. выходы (до 100%) достигаются
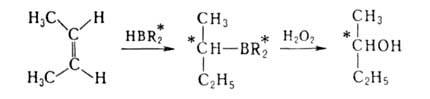
при гидроборировании с помощью моно- или дипинанилборанов (соотв. H2BR*
или HBR2*), получаемых взаимод. В2Н6 с
(-)-пиненом, напр.:
Эпоксидированием алкенов в присут. эфиров (+)-винной к-ты и Ti(OAlk)4
полуиают эпоксиды с оптии. выходом до 90-95%. Во многих А. с. хорошими
вспомогат. реагентами оказались также сульфоксиды с хиральным атомом S,
напр.:
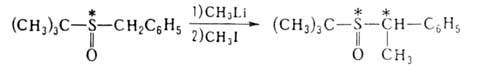
Примеры А. с. в хиральных средах: в холестерин, жидких кристаллах (синтез
транс-циклооктена из циклооктилтри-метиламмонийгидроксида), в краун-эфирах,
содержащих в молекуле дигидроникотиновый фрагмент.
Важное место в А.с. занимает асимметрии, катализ, при к-ром асимметризующим
агентом является катализатор. Различают след, виды асимметрии, катализа.
1) Межфазный катализ в присут. оптически активных иетвертииных аммониевых
оснований, получаемых из эфедрина, хинина и его аналогов. Однако в разл.
р-циях (борогидридное восстановление кетонов, получение вицинальных дигалогенидов,
циангидринов, сульфоксидов и др.), осуществленных этим способом, достигнуты
лишь умеренные оптич. выходы.
2) Гетерог. катализ в присут. металлов, модифицированных оптически активными
соединениями. Высокие оптич. выходы (до 97%) достигнуты при восстановлении
группы С=О метилацетоацетата и ацетилацетона над скелетным Ni, модифицированным
(+)-винной к-той с добавкой NaBr.
3) Гомог. катализ с использованием хиральных родиево-фосфиновых катализаторов
- наиб. быстро развивающаяся область А.с. Чаще всего этот способ используют
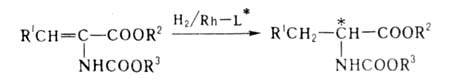
для полунения оптически активных ос-аминокислот гидрированием их предшественников
- ациламиноакриловых к-т:
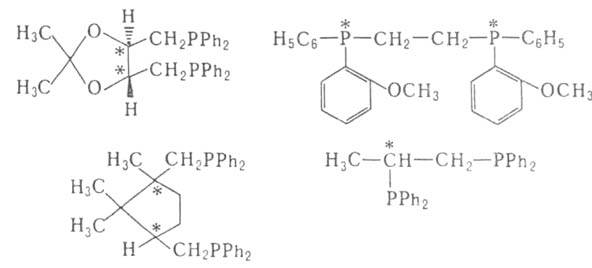
В кач-ве хиральных лигандов L* применяют дифосфины, для синтеза к-рых
используют (+)-винную к-ту, L-гидроксипролин и др., напр.:
Результаты гидрирования определяются природой катализатора, строением
и конфигурацией гидрируемого в-ва (субстрата), р-рителем, т-рой р-ции.
Во мн. случаях достигается очень высокий оптич. выход. Так, асимметрич.
гидрированием получено важное лек. ср-во леводопа [( — )-3-(3,4-дигидроксифенил)-b-аланин]
с оптич. выходом, близким к 100%. С помощью родиево-фосфиновых и др. гомог.
хиральных катализаторов проведены также и др. А.с. - р-ции Гриньяра и Вюрца,
гидросилидирование, гидроформилирование, еновый синтез.
Абсолютный асимметрический синтез осуществляют без участия оптически
активного вспомогат. в-ва, асимметризующее действие оказывает тот или иной
физ. фактор. Напр., в А. с., в к-рых носителями для катализатора (металлы,
щелочи) служат энантиоморфные кристаллы (гл. обр. оптически активного кварца),
роль асимметризующего агента выполняет кристаллич. решетка носителя. Этим
способом осуществлены (хотя и с ничтожными оптич. выходами) термич. деструкция
рацемич. спиртов, изомеризация пропиленоксида, гидрирование рацемич. пинена
и фенилкоричной
к-ты, цианэтилирование 2-метилциклогексанона. Механизм асимметризующего
действия связан с неодинаковой адсорбируемостью энантиомеров на оптически
активном кварце. фенилкоричной
к-ты, цианэтилирование 2-метилциклогексанона. Механизм асимметризующего
действия связан с неодинаковой адсорбируемостью энантиомеров на оптически
активном кварце.
К абс. А. с. относятся также процессы под действием света с круговой
поляризацией, напр, деструкция производных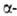 бром- и
бром- и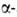 азидопропионовой
к-т, синтез гелиценовых структур в нематич. жидких кристаллах, синтез (+)-винной
к-ты гидроксилированием диэтилового эфира фумаровой к-ты под действием
Н2О2. Решающее значение для осуществления фотохим.
абс. А. с. имеет эффект Коттона (см. Хироптические методы), важной
особенностью к-рого является неравенство коэф. поглощения правого и левого
циркулярно-поляризованного света оптич. изомерами в области оптически активных
полос поглощения (такое явление наз. круговым дихроизмом). Иными словами,
один энантиомер сильнее поглощает одну компоненту циркулярно-поляризованного
света, другой изомер - другую. Если, напр., освещать рацемат однородным
(правым или левым) циркулярно-поляризованным светом, то один из энантиомеров
будет поглощать световой энергии больше, чем другой, и тем самым в большей
степени подвергаться хим. р-ции (напр., разложению). Асимметризующее действие
циркулярно-поляризованного света наблюдалось также в р-циях присоединения
галогенов к триарилметильному радикалу и тринитростильбену. азидопропионовой
к-т, синтез гелиценовых структур в нематич. жидких кристаллах, синтез (+)-винной
к-ты гидроксилированием диэтилового эфира фумаровой к-ты под действием
Н2О2. Решающее значение для осуществления фотохим.
абс. А. с. имеет эффект Коттона (см. Хироптические методы), важной
особенностью к-рого является неравенство коэф. поглощения правого и левого
циркулярно-поляризованного света оптич. изомерами в области оптически активных
полос поглощения (такое явление наз. круговым дихроизмом). Иными словами,
один энантиомер сильнее поглощает одну компоненту циркулярно-поляризованного
света, другой изомер - другую. Если, напр., освещать рацемат однородным
(правым или левым) циркулярно-поляризованным светом, то один из энантиомеров
будет поглощать световой энергии больше, чем другой, и тем самым в большей
степени подвергаться хим. р-ции (напр., разложению). Асимметризующее действие
циркулярно-поляризованного света наблюдалось также в р-циях присоединения
галогенов к триарилметильному радикалу и тринитростильбену.
На границе между А. с. и расщеплением рацематов находятся два способа
получения оптически активных в-в - кинетич. расщепление и асимметрич. превращения
(см. Рацематы). С А. с. их объединяет то, что в этих процессах происходят
хим. превращения, а с расщеплением рацематов - тот факт, что исходными
в-вами являются рацематы.
===
Исп. литература для статьи «АСИММЕТРИЧЕСКИЙ СИНТЕЗ»: Клабуновский Е.И., Стереоспецифический катализ, М., 1968;
Моррисон Д., МошерГ, Асимметрические органические реакции, пер. с англ.,
М., 1973; Идзуми И., Таи А., Сгереодифференцирующие реакции, пер. с англ.,
М., 1979; Потапов В. М., Современный асимметрический синтез, в кн.: Итоги
науки и техники, сер. Органическая химия, т. 4, М., 1984, с. 3-146. В.
М. Потапов.
Страница «АСИММЕТРИЧЕСКИЙ СИНТЕЗ» подготовлена по материалам химической энциклопедии.
|

