|
ПРОТОН (от греч.
protos- первый), стабильная элементарная частица, входящая в состав всех ядер
атомов хим. элементов; ядро атома самого легкого изотопа водорода 1Н
(протия). Обозначается р. Масса П. mp = 1,6726485(86)x
x10-27кг; в атомных единицах массы (а.е.м.) 1,007276470(11);
в энергетич. единицах ~938,3 МэВ. Масса П. в ~ 1836 раз больше массы покоя электрона
и немного меньше массы mn нейтрона: mn —
mp = 1,29344 МэВ. Элект-рич. заряд П. положителен, по абс.
величине он равен заряду электрона 1,6021892 (46)·10-19Кл [или 4,803242(14)·10-10
СГСЭ ед. заряда]; уд. заряд П. очень высок-9,578756(27)x x
107·Кл/кг. Спин П. равен 1/2ђ (ђ-постоянная Планка),
магн. момент mр = 2,792763(30)mN, где
mN- ядерный магнетон.
Число П. в ядре атома данного
хим. элемента равно атомному номеру этого элемента и определяет место элемента
в периодической системе химических элементов. Соотв. все хим. св-ва простых
в-в и соединений, образуемых данным элементом, связаны с числом П. в ядре атома.
Термин "П." ввел Э. Резерфорд в нач. 20-х гг. 20 в.
Согласно классификации
элементарных частиц, П. относится к адронам, он входит в класс тяжелых
частиц-барионов (П.-самый
легкий из барионов). П. участвует в сильных взаимод., а также во всех др. фундам.
взаимод.: электромагнитном, слабом и гравитационном. В сильном взаимодействии
П. и нейтрон имеют идентичные св-ва и рассматриваются как разл. квантовые состояния
одной элементарной частицы-нуклона. За счет слабых взаимод. в радиоактивных
ядрах возможно превращение П. в нейтрон п, позитрон е+ и нейтрино
v: p:n + e+ + v, а также превращение нейтрона
в П., электрон е- и антинейтрино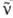 :
n:р+е- + :
n:р+е- +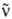 (см. Радиоактивность). Стабильность П. позволяет использовать их как
бомбардирующие частицы для осуществления ядерных реакций, причем П. предварительно
ускоряют до высоких скоростей.
(см. Радиоактивность). Стабильность П. позволяет использовать их как
бомбардирующие частицы для осуществления ядерных реакций, причем П. предварительно
ускоряют до высоких скоростей.
В химии роль П. особенно
велика в кислотно-основном взаимодействии. Согласно разработанной И. Брёнстедом
в 1923 теории к-т и оснований, к-ты-это в-ва, способные отдавать П., а основания-в-ва,
способные принимать П. (см. Кислоты и основания). Из-за высокого
уд. заряда свободные П. не могут существовать в жидких средах; в водных р-рах.
П. претерпевает гидратацию. П., входящие в состав разл. протонных р-рителей,
принимают участие в хим. процессах, протекающих в р-рах; р-рители, не содержащие
таких П., наз. апротонными. Важное значение во мн. хим. р-циях имеет присоединение
П. к молекуле в-ва, напр. при нейтрализации, электроф. присоединении и замещении,
образовании ониевых соед. (см. Протонирование). Р-ции кислотно-основного
катализа зачастую включают стадию переноса П. от субстрата (к-ты или основания)
к катализатору, К-рая наз. протолизом. С. С. Бердоносов
===
Исп. литература для статьи «ПРОТОН»: нет данных
Страница «ПРОТОН» подготовлена по материалам химической энциклопедии.
|

