|
РАДИКАЛЬНЫЕ РЕАКЦИИ,
осуществляются с участием радикального центра своб. радикалов.
Характеризуются, как правило,
большими значениями предэкспоненц. множителя в ур-нии Аррениуса и малыми энергиями
активации Е. Включают по крайней мере две стадии - образование своб.
радикалов и их гибель. Образование своб. радикалов происходит вследствие разрыва
хим. связи, при к-ром на обоих фрагментах молекулы или на одном из них остается
по одному неспаренному электрону, напр.:
Эта р-ция м. б. индуцирована
нагреванием, облучением, действием восстановителей или др. путями.
Радикалы обладают разл.
реакц. способностью, зависящей от их природы, типа р-ций, полярного и стерич.
факторов, эффекта р-рителя.
Реакции между свободными
радикалами. Осуществляются при взаимод. двух одинаковых или разл. радикалов
с образованием новой хим. связи (рекомбинация). Р-ция обычно диффузионно контролируемая;
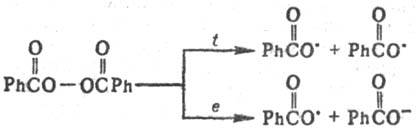
Е от 0 до 5 кДж/моль. Происходит, напр., при дегидродимеризации орг.
соедине-ний под действием пероксидов или др. окислителей, напр.:
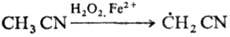
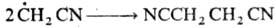
Др. пример рекомбинации
своб. радикалов - электрохим. анодный синтез углеводородов (см. Кольбе реакции):
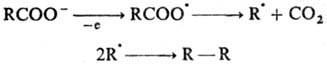
Рекомбинация в -катодном
процессе может происходить при электрохйм. восстановлении, напр., карбонильных
соед.:
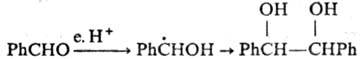
При близком расположении
двух своб. радикалов в "клетке" р-рителя (напр., генерируемых при
термораспаде пероксидов или диазосоединений) р-ция осуществляется с высокой
селективностью (см. Клетки эффект). Влияние этого эффекта уменьшается
с увеличением т-ры и понижением вязкости р-рителя.
При взаимод. двух радикалов
возможно также диспропор-ционирование- перенос атома Н (реже-атома галогена)
от одного радикала к другому, напр.:

Диспропорционирование,
как правило, более медленный процесс, чем рекомбинация. Обе р-ции экзотермичны
и нередко идут одновременно.
Реакции свободных радикалов
с молекулами. Характерны для таких практически важных процессов, как хлорирование,
бромирование, сульфохлорированис, автоокисление, полимеризация и др., протекающих
по цепному механизму (см. Цепные реакции). Их константы скорости на неск.
порядков ниже, чем для рекомбинации; Е = 20-60 кДж/моль. Так, р-ция
автоокисления осуществляется в результате многократно повторяющихся р-ций по
схеме:
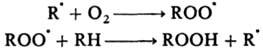
Обрыв цепи происходит путем
рекомбинации с с или
с ROO•. Для торможения автоокислит. процессов используют ингибиторы,
обычно пространственно-затрудненные фенолы или ароматич. амины. Радикалы,
взаимодействуя с ингибиторами, образуют неактивные феноксильные или аминильные
радикалы, к-рые не способны участвовать в стадиях роста цепи. Механизм, подобный
описанному, обусловливает защитные св-ва витамина Е при действии О2
на клетки живых организмов. или
с ROO•. Для торможения автоокислит. процессов используют ингибиторы,
обычно пространственно-затрудненные фенолы или ароматич. амины. Радикалы,
взаимодействуя с ингибиторами, образуют неактивные феноксильные или аминильные
радикалы, к-рые не способны участвовать в стадиях роста цепи. Механизм, подобный
описанному, обусловливает защитные св-ва витамина Е при действии О2
на клетки живых организмов.
Механизм р-ции замещения
радикалами алкильных, тиильных, ацилоксильных, алкоксильных и нек-рых др. групп
включает разрыв связи в исходной молекуле и образование новой связи с участием
радикала, напр.:
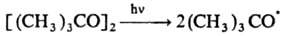
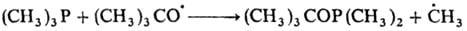
По аналогии с нуклеоф.
р-циями замещения такой механизм наз. механизмом SR2.
Стереохимия р-ции зависит
от характера субстрата. Обычно образующийся радикал с неспаренным электроном
у хирального атома С имеет плоскую или близкую к плоской конфигурацию, что приводит
к рацемизации. В циклич. системах инверсия радикального центра затруднена, особенно
в случае малых циклов, напр.:
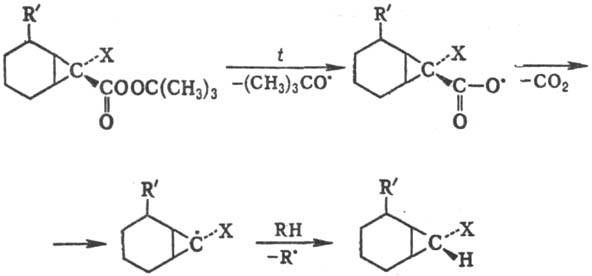
Р-ции радикального замещения
в ароматич. ядре обычно не являются цепными и осуществляются через стадию образования
циклогексадиенильных радикалов:
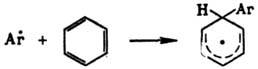
Превращение в конечный
продукт происходит в результате отрыва атома Н (р-ция 1); побочные процессы-рекомбинация
(2) и диспропорционирование (3):
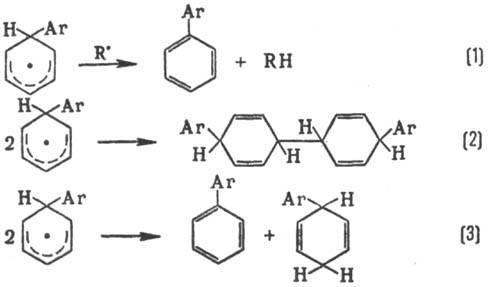
Электронедонорные и электроноакцепторные
заместители активируют ароматич. ядро. В р-циях образуются о, м, и n-изомеры
с преобладанием о-изомера.
Гидроксильные радикалы,
к-рые генерируются реактивом Фентона (Н2О2+Fe2+),
способны атаковать неактивир. ароматич. ядро. При этом образуется радикал, к-рый
диме-ризуется или в присут. Fe3+ превращ. в фенол:
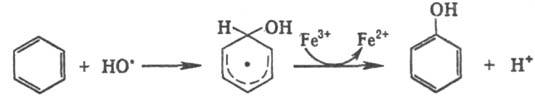
Среди р-ций радикального
замещения в ароматич. ядро практич. значение имеет алкилирование протонир. гетеро-ароматич.
соединений с атомом N в кольце. В пиридинах и хинолинах замещение происходит
у атомов С в положениях 2 и 4.
Свободнорадикальное присоединение
по связи С=С-цепной процесс с короткими кинетич. цепями. Инициируется пероксидами,
ионами переходных металлов и УФ облучением. Р-ция нестереоселективна для алкенов,
высокостерео-селективна (транс-присоединение) для циклоалкенов; Е
обычно не превышает 40 кДж/моль.
К 1-алкенам радикал обычно
присоединяется по а-атому С, напр.:
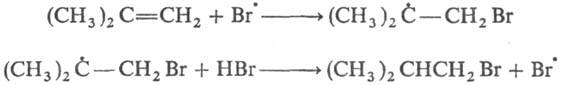
Свободнорадикальное присоединение
НВr к несимметричным олефинам идет против правила Марковникова. Это объясняется
тем, что в случае атаки такого олефина р-ция осуществляется по пути образования
более стабильного радикала (увеличение числа алкильных заместителей при радикальном
центре увеличивает стабильность радикала), поболее
доступному атому С и па месту наиб. электронной плотности
в молекуле, напр.:
Свободнорадикальное присоединение
по связи С=С широко используется в органическом синтезе, в т.ч. в промышленности.
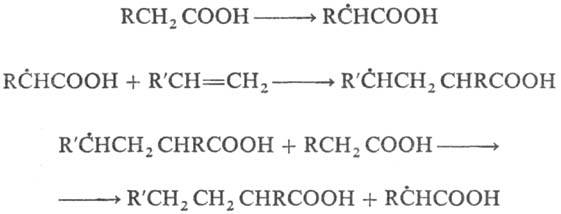
К реакциям свободнорадикального
присоединения относится также теломеризация - цепная реакция непредельных
соед. в присут. в-в (телогенов), в результате к-рой образуется смесь низкомол.
гомологов (теломе-ров). Реакция используется в пром-сти для получения a,
a, a, w-тетрахлоралканов из СС14 и этилена и разветвленных
карбоновых к-т из пропионовой к-ты и этилена, напр.:
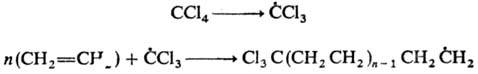
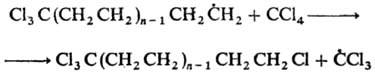
По аналогичному механизму
осуществляется радикальная полимеризация непредельных соединений.
Внутримолекулярные реакции
свободных радикалов. К этому типу р-ций относится фрагментация - распад
радикала на молекулу и радикал с меньшей мол. массой. Р-ция характерна для мн.
b-галоген-, b-тио-, a-гидроксиалкильных радикалов, а также для
алкоксильных, ацилоксильных и нек-рых др. радикалов. Если фрагментация возможна
по неск. направлениям (напр., при окислении несимметричных третичных спиртов),
реализуется преим. то, к-рое приводит к более стабильному радикалу, напр.:
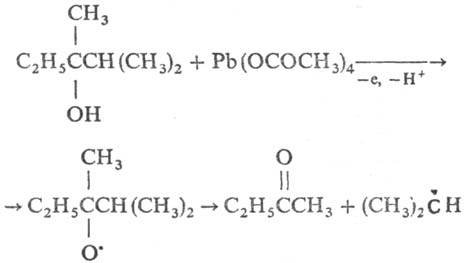
Т.к. в р-циях этого типа
гемолизу подвергается связь, обычно расположенная в b-положении по отношению
к неспаренному электрону, то такой процесс иногда наз. b-рас-щеплением
или b-распадом. Ацильные радикалы, генерируемые из альдегидов, легко фрагментируют
при т-ре выше 100°С на алкильные радикалы и СО.
Фрагментацию циклоалкоксильных
радикалов, генерируемых из циклоалканолов или циклоалканонов, используют в синтезе
алифатич. бифункцион. соединений по схеме:
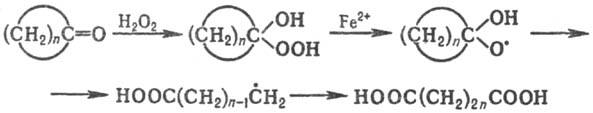
Фрагментация промежуточно
образующихся алкильных радикалов происходит при получении этилена путем пиролиза
нефтяных углеводородов.
Радикалы могут претерпевать
перегруппировки с миграцией атомов и(или) функц. групп. При этом всегда происходит
образование более стабильного радикала, чем исходный. Для алкильных, алкоксильных,
аминилъных, амидиль-ных радикалов характерна 1,5-миграция атома Н от атома С
к радикальному центру. Эта р-ция - ключевая стадия при окислении алканолов в
тетрагидрофураны, карбоновых к-т в g-лактоны, метилалкилкетонов в g-дикетоны,
напр.:
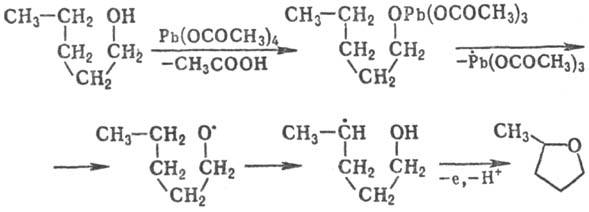
Иногда наблюдается наряду
с 1,5- также и 1,6-миграция атомов Н, значительно реже-1,3- и 1,4-миграции.
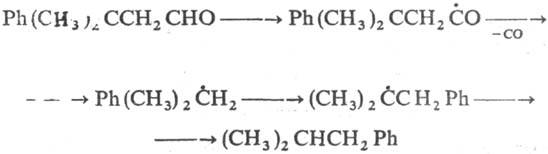
Известны примеры р-ций
С-центрированных радикалов с 1,4-миграцией арилов или группы CN, с 1,2-миграцией
атомов С1, Вr или арильных, ацетоксилъных, ацильных и винильных группировок,
напр.:
Известно также внутримол.
присоединение углерод- или кислород центрированных радикалов к кратным связям
или к ароматич. ядру. Таким путем легко образуются 5- и 6-членные циклы, напр.:
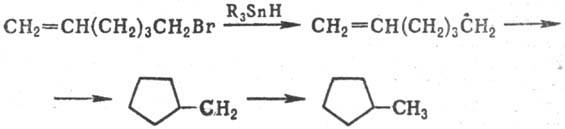
Окисление и восстановление
свободных радикалов. Наиб. известно
одноэлектронное окисление С-центрированных радикалов солями Сu(II), Co(III),
Mn(III), Fe(III), Pb(IV), Се (IV). Р-ция осуществляется с высокими скоростями
с переносом лиганда (С1, Вг, CN и др.), напр.:
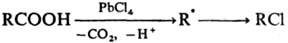
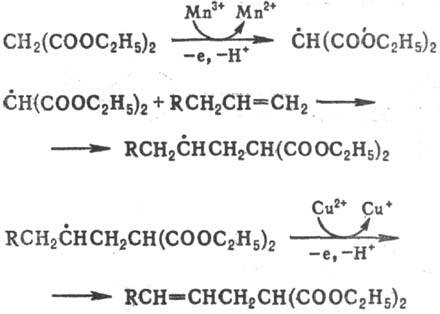
При окислении ацетатом
или сульфатом Сu(II) р-ция сопровождается депротонированием, что приводит к
образованию двойной связи; р-ция используется в синтезе непредельных соед. с
функц. группами, напр.:
Восстановление-типичная
р-ция феноксильных и нйтро-ксильных радикалов, напр.:
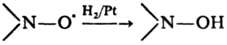
Относительно легко восстанавливаются
по механизму переноса электрона С-центрированные радикалы с электро-ноакцепторными
заместителями при радикальном центре, напр.:
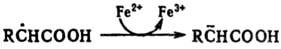
См. также Радикалы свободные.
===
Исп. литература для статьи «РАДИКАЛЬНЫЕ РЕАКЦИИ»: НонхибелД.,
Уолтон Дж., Химия свободных радикалов, пер. с англ., М., 1977; Розанцев Э.Г.,
Шолле В. Д., Органическая химия свободных радикалов, М., 1979; Девис Д., Перрет
М., Свободные радикалы в органическом синтезе, пер. с англ., М., 1980; Нонхибел
Д., Теддер Дж., Уолтон Дж., Радикалы, пер. с англ., М., 1982; Free radicals,
ed. by J.K. Kochi, v. 1-4, N.Y., 1973-80; Selectivity and synthetic applications
of radical reactions. Tetrahedrpn symposia-in-print, "Tetrahedron",
1985, v. 41, № 19; Giese В., Radical in organic synthesis. Formation of carbon
bonds, Oxf., 1986; Curran D.P., "Synthesis", 1988, № 6, p. 417-39;
там же, 1988, № 7, p. 489-513.
Г. И. Никишин.
Страница «РАДИКАЛЬНЫЕ РЕАКЦИИ» подготовлена по материалам химической энциклопедии.
|

