|
АСТАТ (от греч. astatos-неустойчивый; лат. Astatium) At, радиоактивный
хим. элемент VII гр. периодич. системы, относится к галогенам, ат.
н. 85. Стабильных изотопов не имеет. Известно более 20 изотопов с мае.
ч. от 196 до 219; наиб. долгоживущие - 210А1 (T1/2
8,1 ч) и 211At(T1/2 7,21 ч). Конфигурация внеш. электронных
оболочек атома 4f145d106s2p5;
степени окисления —1, 0, +1, +5 и, возможно, + 7; энергии ионизации At0
->
At+ -> At2+ равны соотв. 9,2 и 20,1 эВ; электроотрицательностъ
по Полингу 2,3; ковалентный радиус 0,144 нм, ионные радиусы At+
0,122 нм и At- 0,232 нм (оценочные данные). В атомном спектре
А. обнаружены линии 224, 401 нм и 216, 225 нм. Молекулы своб. А., вероятно,
двухатомны; энергия диссоциации ~ 114 кДж/молъ.
Общее содержание А. в слое земной коры толщиной 1,6 км оценивается в
~ 70 мг. Для изучения св-в А. доступны только его ультрамалые кол-ва (макс.
масса А., с к-рой имели дело исследователи, была 2-10-9 г; концентрация
А. в р-ре обычно составляет 10-15--10-9 моль/л).
А. - твердое в-во; т.пл. 244°С, т. кип. 309 °С. Потенциал осаждения А.
на катоде —1,22 В, на аноде 1,45 В. Для А. характерно сочетание св-в неметаллов
(галогенов) и металлов (Ро, Рb и др.). Так, аналогично иоду, А. хорошо
раств. в орг. р-рителях и легко ими экстрагируется; по летучести он несколько
уступает I2, но также может легко отгоняться. При действии на
водный р-р А. водорода в момент р-ции образуется газообразный HAL Подобно
12, А. в водном р-ре восстанавливается SO2 и окисляется
Вr2. Однако, как и металлы, А. можно осадить из солянокислых
р-ров сероводородом. В присут. окислителей в водных кислых р-рах А. существует
в виде однозарядного катиона предполагаемого состава [At(H2O)x]+,
где х = 1 или 2
А. получают облучением металлич. Bi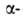 частицами
высокой энергии или металлич. Th протонами с энергией 660 МэВ с послед.
отделением и очисткой А. методами соосаждения, экстракции, дистилляции
и др. частицами
высокой энергии или металлич. Th протонами с энергией 660 МэВ с послед.
отделением и очисткой А. методами соосаждения, экстракции, дистилляции
и др.
А. впервые получили искусственно Д. Корсон, К. Макензи и Э. Сегре в
1940. В 1943-46 было установлено существование быстрораспадающихся изотопов
А. в природе (как членов прир. радиоактивных рядов); самый устойчивый из
них 219At(T1/2 54 с;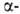 излучатель). излучатель).
===
Исп. литература для статьи «АСТАТ»: Chalk in W.A., Herrmann E., "Isotopcnpraxis", 1975, Bd
11, H. 10, S. 333-40; Downs A., Adams C. G., The chemistry of chlorine,
bromine, iodine and astatinev Oxf.-[a.o.], 1975. C.C. Бердоносов.
Страница «АСТАТ» подготовлена по материалам химической энциклопедии.
|

