|
РАСТВОРИМОСТЬ, способность
в-ва образовывать с др. в-вом (или в-вами) гомог. смеси с дисперсным распределением
компонентов (см. Растворы). Обычно растворителем считают в-во,
к-рое в чистом виде существует в том же агрегатном состоянии, что и образовавшийся
р-р. Если до растворения оба в-ва находились в одном и том же агрегатном состоянии,
р-рителем считается в-во, присутствующее в смеси в существенно большем кол-ве.
Р. определяется физ. и
хим. сродством молекул р-рителя и растворяемого в-ва, соотношением энергий взаимод.
однородных и разнородных компонентов р-ра. Как правило, хорошо раств. друг в
друге подобные по физ. и хим. св-вам в-ва (эмпирич. правило "подобное
раств. в подобном"). В частности, в-ва, состоящие из полярных молекул,
и в-ва с ионным типом связи хорошо раств. в полярных р-рителях (воде, этаноле,
жидком аммиаке), а неполярные в-ва хорошо раств. в неполярных р-рителях (бензоле,
сероуглероде).
Согласно теории, предложенной
Дж. Гильдебрандом (1935), взаимная Р. неэлектролитов возрастает с уменьшением
разности их параметров растворимости d=(Е/V)1/2,
где Е-теплота
испарения, V-полярный объем. Параметр р-римости - одно из осн. понятий,
определяющих когезион-ные св-ва в-в в конденсир. состояниях; важная технол.
характеристика полимеров и р-рителей, лакокрасочных материалов и т.п. (см. Когезия).
Р. мн. электролитов возрастает пропорционально кубу диэлектрич. проницаемости
р-рителя. Обычно более растворимы электролиты с большей склонностью к сольватации
р-рителем; образование кристаллогидратов обычно увеличивает Р. солей.
Р. данного в-ва зависит
от т-ры и давления соотв. общему принципу смещения равновесий (см. Ле Шателье-Брауна
принцип). Концентрация насыщ. р-ра при данных условиях численно определяет
Р. в-ва в данном р-рителе и также наз. растворимостью. Пересыщенные р-ры содержат
большее кол-во растворенного в-ва, чем это соответствует его Р., существование
пересыщенных р-ров обусловлено кинетич. затруднениями кристаллизации (см. Зарождение
новой фазы). Для характеристики Р. малорастворимых в-в используют
произведение активностей ПА (для р-ров, близких по своим св-вам к идеальному,-произведение
р-римости ПР).
Растворение газов в воде-экзотермич.
процесс, поэтому с ростом т-ры Р. газов в воде уменьшается. В орг. р-рителях
газы часто раств. с поглощением тепла и с ростом т-ры Р. газов повышается. В
нек-рых случаях на кривых зависимости р-римости газов от т-ры наблюдается минимум
(напр., система водород-вода). При постоянной т-ре в случае образования идеального
разб. бинарного р-ра неэлектролита Р. газа (молярная доля в р-ре) пропорциональна
его парциальному давлению над р-ром (см. Генри закон). С ростом
давления для определения Р. газа необходимо учитывать отклонение его св-в от
св-в идеального газа, что достигается заменой парциального давления летучестью.
Системы жидкость - жидкость
(жидкие смеси) различаются по след. типам: жидкости смешиваются друг с другом
во всех отношениях (напр., система вода - этанол); жидкости практически нерастворимы
друг в друге (вода-ртуть); жидкости частично растворимы друг в друге (вода-диэтиловый
эфир). С ростом т-ры взаимная Р. жидкостей в большинстве случаев увеличивается
и, если не достигается т-ра кипения, существует т-ра, при к-рой обе жидкости
смешиваются друг с другом в любых соотношениях,-т. наз. критич. т-ра р-римости,
или верх. критич. точка смешения (ВКТС). Если достигается т-ра кипения, осуществляется
трехфазное равновесие с участием паровой фазы и двух жидких фаз-паровая эвтектика
или паровая перитектика. В нек-рых системах взаимная Р. повышается с понижением
т-ры и возможно достижение ниж. критич. т-ры смешения (HKTС). Известны системы
(напр., вода-трибу-тилфосфиноксид), где имеется и верхняя и нижняя критич. точки
(см. Критическое состояние). Обычно область расслаивания жидкой
смеси при понижении т-ры пересекается с линией ликвидуса с образованием монотектич.
или синтек-тич. фазового равновесия (см. Диаграмма состояния).
Влияние давления на Р.
зависит от того, как изменяется с давлением молярный объем в-ва и его парциальный
молярный объем в р-ре. Если при нек-ром давлении молярный объем в-ва становится
меньше его парциального молярного объема, Р. в-ва с ростом давления снижается.
Такая закономерность характерна для неполярных р-рителей; напр., Р. гексахлорэтана
в сероуглероде при 500 МПа меньше, чем при 0,1 МПа, в 15 раз. Для газов при
высоких давлениях на кривой зависимости Р. от давления имеется максимум. Для
электролитов на зависимость Р. от давления сказывается изменение молярного объема
вследствие сольватации ионов молекулами р-рителя. Взаимная Р. жидкостей
мало зависит от давления, зависимость становится заметной при давлениях порядка
неск. ГПа.
В-во, способное раств.
в двух неограниченно смешивающихся друг с другом р-рителях, распределяется между
ними так, что отношение его активностей в этих р-рителях а1
и а2 при постоянной т-ре остается постоянным, независимо
от общего кол-ва растворенного в-ва: a1/a2
= К, где К - коэф. распределения (закон Бертло-Нернста). Для
сильно разб. р-ров вместо отношения активностей компонентов можно записать отношение
их концентраций.
Растворение твердых тел
в жидкостях может сопровождаться поглощением тепла, в этом случае повышение
т-ры приводит к увеличению Р. Если образуется идеальный р-р, зависимость Р.
от т-ры записывается ур-нием Шредера
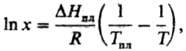
где DHпл и
Тпл -энтальпияплавления и -т-ра плавления растворенного в-ва.
Если энергия сольватации больше энергии, необходимой для разрушения кристаллич.
решетки, растворение является экзотермич. процессом и Р. с ростом т-ры понижается.
У нек-рых в-в (напр., гипс) наблюдается минимум на кривой зависимости Р. от
т-ры. При образовании твердых растворов максимум Р. достигается, как
правило, при т-ре трехфазного равновесия - эвтектического или перитектического.
Но в нек-рых системах максимум Р. отвечает более высокой т-рс (системы с ретроградной
растворимостью).
Р. изучают изотермич. или
политермич. методами (см. Термический анализ). Полученные результаты
представляют в виде диаграмм Р., к-рые являются частным случаем диаграммы состояния.
Объемное изображение фазовых состояний системы в пространстве параметров состояния
(т-ры и составов разл. фаз) сводят спец. приемами к фигурам на плоскости. Для
тройной системы из двух солей и воды используют обычный концентрац. треугольник,
вершины к-рого отвечают чистым компонентам (см. Многокомпонентные системы).
Применяют также изображение Р. по способу Шрейнемакерса (Ф. Схрейнемакерс),
при к-ром вершина прямоугольной системы координат отвечает чистой воде, а по
обеим осям откладывают концентрации солей, выраженные кол-вом той или другой
соли на определенное кол-во воды (1 моль). Точки, отвечающие чистым солям, лежат
в бесконечности (см. рис. а). Др. прием построения диаграмм Р.
на плоскости - способ Йенеке (см. рис. б): на оси абсцисс отражается
состав солевой массы р-ра, т.е. соотношение концентраций солей, а по оси ординат
откладывается кол-во воды на определенное кол-во растворенных в-в (напр., 1
моль). В этом способе в бесконечности находится точка, отвечающая чистой воде.
На диаграммах (см. рис. а и б) буквой Ж обозначено
фазовое поле гомог. системы (р-ра), Ж+А и Ж+В- фазовые поля пересыщенных
р-ров, Ж + А + В - тройная пересыщенная система; линии А'E отвечают
р-рам, насыщ. компонентом А (концентрация насыщения при данном содержании В),
линии ЕB'-р-рам, насыщенным компонентом В, Е-эвто-нич.
точка системы (эвтоника), отвечающая составу р-ра, насыщенного двумя компонентами
(аналог эвтектики на диаграммах плавкости). Точка эвтоники характеризуется макс.
концентрацией растворенных в-в в р-ре, миним. парциальным давлением пара р-рителя
над р-ром, постоянством состава р-ра и давления пара при изотермич. испарении
вплоть до окончат. высыхания системы.
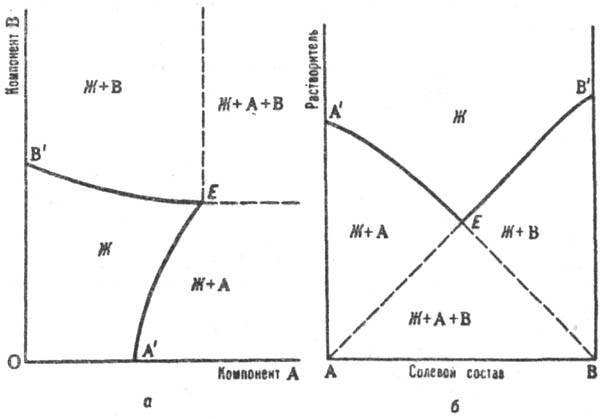
Изотермич. диаграмма р-римости
тройной системы соль А - соль В - вода с изображением по способу Шрейнемакерса
(а) и по способу Йенеке (б). Пояснения в тексте.
Использование диаграмм
Р. позволяет установить сосуществующие фазы при данной т-ре и соответствующие
им составы р-ров, провести расчеты процессов испарения, кристаллизации из р-ров
и т. п., что необходимо для обоснования многих технол. схем. Напр., диаграмма
Р. системы KCl-NaCl-H2O является основой технологии переработки сильвинитов,
системы K2SO4-MgCl2-H2O-переработки
полиминеральных галургич. руд.
===
Исп. литература для статьи «РАСТВОРИМОСТЬ»: Новоселова
А. В., Методы исследования гетерогенных равновесий, М., 1980; Ксензенко В. И.,
Кононова Г. Н., Теоретические основы переработки галургического сырья, М., 1982.
П. И. Федоров.
Страница «РАСТВОРИМОСТЬ» подготовлена по материалам химической энциклопедии.
|

