|
РОБИНСОНА-МАННИХА РЕАКЦИЯ,
получение бициклич. непредельных кетонов взаимод. циклич. кетонов с четвертичными
солями b-аминокетонов (их получают взаимод. алкилиодидов с соответствующими
основаниями Манниха) в присут. оснований (В):
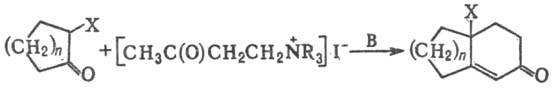
X=H,Alk,Ar,RCOO,ROC(O);
R = CH3,C2H5; B
= NaNH2,NaOH,RONa; n=2-11
Р-цию проводят в орг. р-рителе
(напр., в смеси этанола и эфира). Смесь реагентов обычно выдерживают неск. часов
при комнатной т-ре, затем кипятят.
Циклич. кетон можно активировать,
превратив его в промежут. a-гидроксиметиленкетон:
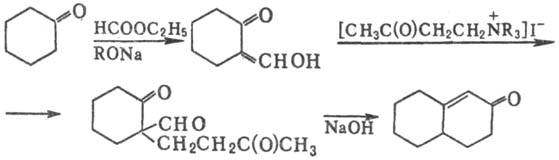
Выходы составляют 40-60%.
Механизм Р.-М.р. недостаточно
изучен. Предполагают, что первоначально при взаимод. четвертичной соли b-аминокетона
с основанием образуется алкилвинилкетон, к-рый вступает в р-цию c енолят-анионом,
образующимся при действии основания на циклич. кетон, напр.:
•c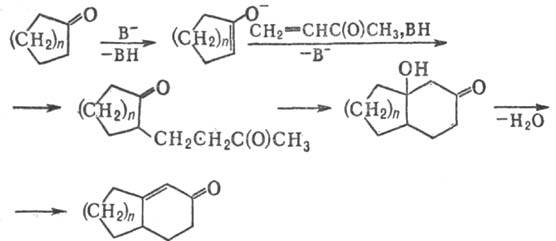
Вторая и последующие стадии
Р.-М.р.-частный случай присоединения по Михаэлю (см. Михаэля реакция).
Модификации Р.-М.р.: 1)
получение мостиковых углеводородов при использовании четвертичных бисоснований
Манниха, напр.:
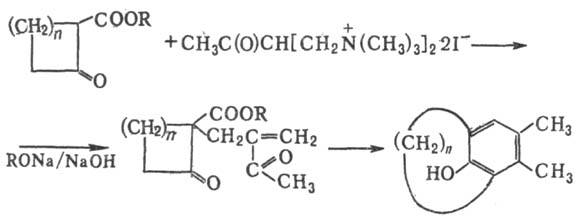
2) Получение бициклич.
дикетонов взаимод. циклич. дикетонов с метилвинилкетонами:
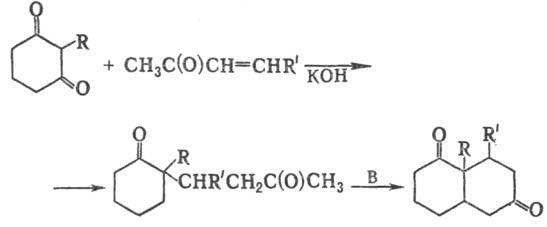
3) Синтез бициклич. непредельных
кетонов с использованием b-аминокетона или его гидрохлорида, напр.:
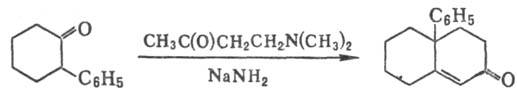
Р.-М.р. используют в препаративной
практике для синтеза терпенов, конденсир. циклич. углеводородов, соед., родственных
стероидам и алкалоидам.
Р-ция открыта Р. Робинсоном
и К. Маннихом в 1937.
===
Исп. литература для статьи «РОБИНСОНА-МАННИХА РЕАКЦИЯ»: Брестер Дж.Х.,
Элиель Э.Л., в сб.: Органические реакции,, пер. с англ., сб. 7, М., 1956, с.
146-259; Gawley R. E., "Synthesis", 1976, № 12, p. 777-94.
Г. И. Дрозд.
Страница «РОБИНСОНА-МАННИХА РЕАКЦИЯ» подготовлена по материалам химической энциклопедии.
|

