|
РОДОПСИН (зрительный
пигмент), светочувствительный белок палочек сетчатки глаза позвоночных животных
и зрительных клеток беспозвоночных.
Р.-гликопротеин (мол. м.
ок. 40 тыс.; полипептидная цепь состоит из 348 аминокислотных остатков), содержащий
хромофорную группу (хромофор). В молекуле Р. находится ок. 60% гидрофобных аминокислотных
остатков. В N-KOH-цевой области Р. расположены две олигосахаридные цепи, ковалентно
связанные с остатками аспарагина. Известна первичная структура Р., выделенных
из разл. источников. Хромофор большинства Р.-остаток 11-цис-ретиналя
(см. Витамин А), связанный альдиминной связью с e-аминогруппой
остатка лизина (у быка он находится в положении 296).
Спектр поглощения у этих белков имеет три максимума-ок. 500, 350 и 280 нм. Первые
два максимума обусловлены хромофором, третий-в осн. белковой частью молекулы.
В спектре кругового дихроизма Р. имеются два положит. максимума (500 и 350 нм)
и один отрицательный (220 нм); lмакс флуоресценции 580 нм, квантовый
выход 5·10-3.
У нек-рых рыб и амфибий
хромрфором зрительного пигмента служит остаток 11-цис-3,4-дидегидроретиналя
(в этом случае белок наз. порфиропсином).
Р. расположен трансмембранно
в дисках палочек сетчатки глаза (рис. 1). Наиб. значит. участки вне мембраны-N-
и С-концевые области молекулы (N-конец расположен внутри диска, С-конец-на внеш.
стороне мембраны диска).
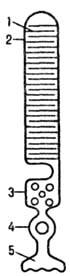
Рис. 1. Схематич. изображение
палочки сетчатки: 1-диск; 2-наружный сегмент; 3-внутр. сегмент; 4-ядро; 5-пре-синаптич.
окончание.
При поглощении кванта света
начинается многоступенчатый процесс обесцвечивания, или фотолиза, Р. (рис.2);
квантовый выход фотолиза 0,67. На первой стадии (до образова-ния батородопсина)
происходит изомеризация хромофора из 11-цис-формы в полностью транс-форму,
а на стадии батородопсина начинаются конформац. изменения белка, сначала
в месте расположения хромофора, а затем и в др. местах молекулы. Это приводит
к образованию др. проме-жут. продуктов, различающихся по спектральным св-вам.
У позвоночных фотолиз заканчивается отрывом хромофора от белка (белковая часть
Р. наз. опсином); у беспозвоночных хромофор остается связанным с белком на всех
стадиях фотолиза.
У позвоночных Р. регенерируется обычно в результате взаимод. опсина с 11-цис-ретиналем,
у беспозвоночных-при поглощении второго кванта света.
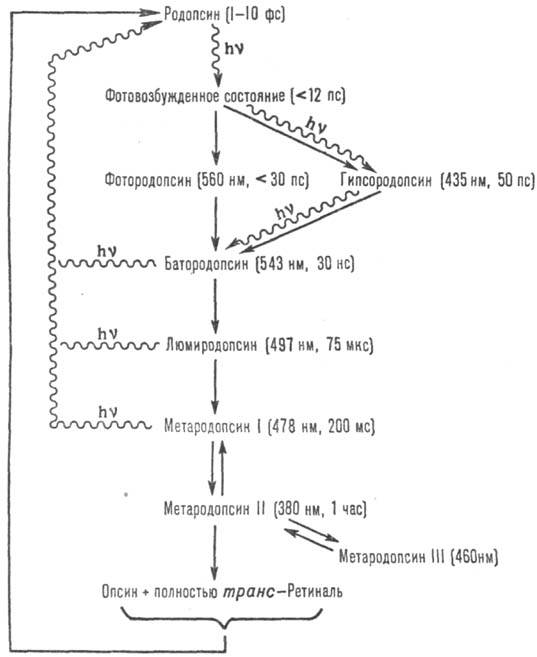
Рис. 2. Промежут. этапы
фотолиза и регенерации родопсина быка. Превращения, показанные волнистой линией,
идут с поглощением кванта света; в скобках приведены lмакс поглощения
и время перехода (при комнатной т-ре) к послед. промежут. продукту.
Плазматич. мембрана наружного
сегмента в темноте высоко проницаема для ионов Na+, благодаря чему
эти ионы быстро проникают внутрь наружного сегмента (высокий градиент в мембране
концентрации ионов Na+ поддерживает Na+, К+-аденозинтрифосфатаза),
диффундируют далее во внутр. сегмент и затем выводятся с помощью Na+,
К+-насоса за счет энергии АТФ.
Предполагают, что мол.
механизм блокирования Na+-каналов инициируется метародопсином II
(активированный Р.), к-рый взаимод. с трансдуцином (G-белок, мол. м. 42 тыс.).
Последний м. б. связан с гуанозиндифосфатом или гуанозинтрифосфатом (соотв.
ГДФ и ГТФ). В трансдуцине, связанном с активированным Р., происходит обмен ГДФ
на ГТФ.
Одна молекула активированного
Р. до ее дезактивации способна активировать ок. 500 молекул трансдуцина. Трансдуцин
с ГТФ активирует одну молекулу фосфоди-эстеразы, к-рая за время одного цикла
разлагает ок. 1000 молекул циклич. гуанозинмонофосфата (цГМФ). Общее усиление
сигнала-ок. 106. Уменьшение концентрации цГМФ приводит к закрытию
натриевых цГМФ-регулируемых каналов, поток Na+ уменьшается, мембрана
гиперполяри-зуется.
Возникновение такой поляризации
запускает р-ции световой адаптации клетки по принципу обратной связи. Закрытие
Na+-каналов блокирует проникание Са2+ в наружный сегмент,
в то же время выход Са2+ в результате Na+-Ca2+-обмена
продолжается. Это приводит к активации гуанилатциклазы и частично, по-видимому,
к ингибиро-ванию фосфодиэстеразы. В результате этого концентрация цГМФ увеличивается
и Na+-каналы открываются.
Зрительный пигмент колбочек
(они ответственны за цветовое зрение)-иодопсин в качестве хромофора также содержит
остаток ретиналя. Однако его белковый компонент отличается от опсина палочек.
Иодопсин претерпевает превращения, сходные с превращениями Р.
===
Исп. литература для статьи «РОДОПСИН»: Страйер Л.,
Биохимия, пер. с англ., т. 3, М., 1985, с. 340-48; Ovchinnikov Yu. А.,
"FEES letters", 1982, v. 148(2), p. 179-91; Applebury M., Hargrave
P., "Visual Res.", 1986, v. 26 (12), p. 1881-95; Shichida Y., "Photobio-chemistry
and Photobiophysics", 1986, v. 13 (3), p. 287-307; Pugh E., Cobbs W.,
"Visual Res.", 1986, v. 26 (10), p. 1613-43; Bennett N.. Sitaramayya
A., "Biochemistry", 1988, v. 27 (5), p. 1710-15. И.Б. Федорович.
Страница «РОДОПСИН» подготовлена по материалам химической энциклопедии.
|

