|
РТУТИ ГАЛОГЕНИДЫ, моногалогениды
Hg2X2 и дигало-гениды HgX2. P. г.-кристаллы
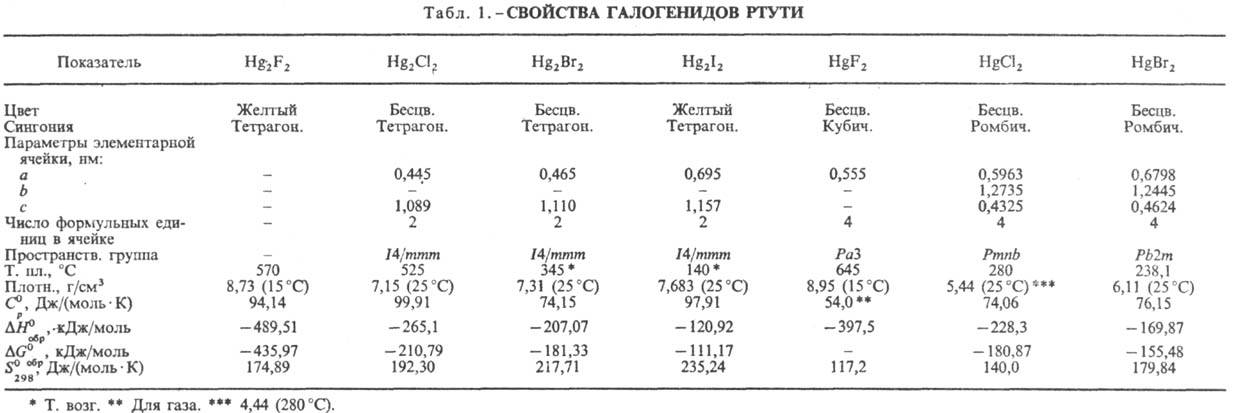
(табл. 1). Моногалогениды Hg2X2, где X = Сl, Вr, I, малорастворимы
в воде, не раств. в орг. р-рителях. Особенность в хим. поведении Hg2X2-способность
ионов 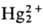 к диспропорционированию: к диспропорционированию:
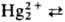 Hg2+ + Hg0, в р-ре равновесие сдвигается вправо в присут.
избытка ионов Сl-, Вr-, а также лигандов, с к-рыми ион
Hg2+ образует прочные комплексы (ОН-, S2-,
CN-, I-, амины, алкилсульфиды); в присут. металлич. ртути
в р-ре отношение концентраций [Hg2+]/[
Hg2+ + Hg0, в р-ре равновесие сдвигается вправо в присут.
избытка ионов Сl-, Вr-, а также лигандов, с к-рыми ион
Hg2+ образует прочные комплексы (ОН-, S2-,
CN-, I-, амины, алкилсульфиды); в присут. металлич. ртути
в р-ре отношение концентраций [Hg2+]/[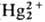 ]
= 0,0183. Ионы ]
= 0,0183. Ионы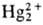 образуются при восстановлении солей Hg(II), легко
окисляются до Hg2+ и восстанавливаются до металла. Ион
образуются при восстановлении солей Hg(II), легко
окисляются до Hg2+ и восстанавливаются до металла. Ион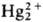 образует комплекс с оксалат-, сукцинат-, пирофосфат-,
триполифосфатанионами и др.
образует комплекс с оксалат-, сукцинат-, пирофосфат-,
триполифосфатанионами и др.
Дигалогениды HgX2
раств. в воде и орг. р-рйтелях, в отличие от большинства др. солей в водных
р-рах практически не диссоциируют. В водных р-рах в присут. избытка MX, где
М = Na, К, Rb, образуют хорошо р-римые комплексы M2[HgX4].
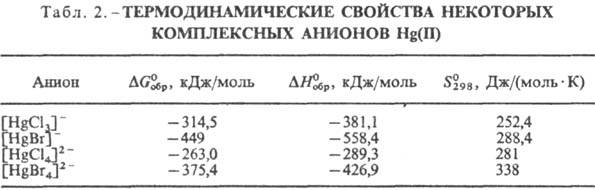
Константа устойчивости К комплексов [HgX4]2- увеличивается
в ряду Сl < Вr < I (К = 15,93, 21,0, 30,17 соотв.; о др. св-вах
см. табл. 2). Константы равновесия р-ции обмена HgX2 +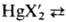 2HgXX',
где X,X' = С1, Вг, I, для
галогенидов HgClI, HgClBr, HgBrI равны соотв. 10, 4,0 и 3,2. 2HgXX',
где X,X' = С1, Вг, I, для
галогенидов HgClI, HgClBr, HgBrI равны соотв. 10, 4,0 и 3,2.
Получают Р. г. из простых
в-в, взаимод. HgO, Hg2O, HgCO3 с галогеноводородами и
др. методами.
Фторид Hg2F2
на свету быстро темнеет, лучше раств. в воде, чем Hg2Cl2,
легче диспропорционирует в воде; применяют для приготовления электродов сравнения.
Хлорид (каломель) Hg2Cl2
при 383,7 °С возгоняется с разл. на Hg и HgCl2; разлагается также
на свету; окисляется до HgCl2 при действии С12 и FeCl3;
р-римость в воде (г в 100 г): 0,0002 (25 °С), 0,001 (43 °С); плохо раств.
в соляной к-те, горячей HNO3; применяют для изготовления электродов
сравнения, как антисептик, катализатор орг. р-ций, для синтеза ртутьорг. соединений.
Бромид Hg2Br2:
р-римость в воде 4·10-6 г в 100 г при 25 °С, раств. при натр.
в конц. HNO3, горячей конц. H2SO4 и горячем
р-ре (NH4)2CO3; получают, кроме общих методов,
анодным растворением Hg в бромистоводородной к-те, действием КВr на р-р Hg2(NO3)2
в HNO3; применяют для приготовления электролитов при рафинировании
Hg, для электрохим. экспериментов, для синтеза ртутьорг. соединений.
Иодид Hg2I2
разлагается до Hg и HgI2 на свету, при нагр. выше 290 °С; произведение
р-римости в водном р-ре 2,01·10-30 (10,8°С), 7,42·10-29
(26,5°С), раств. в касторовом
масле и р-рах KI и NH3; м. б. получен при действии HgI2 на
избыток Hg при т-ре выше 290 °С, обработкой Hg2Cl2 в
спиртовом р-ре KI дихлоридом Sn; применяют в люминесцентных лампах.
Дифторид HgF2:
т. кип. >650°С; легко образует кристаллогидрат HgF2-2H2O;
разлагается водой; раств. во фтористоводородной к-те, разб. HNO3;
получают общими методами, а также действием F2 на HgCL, р-цией Hg2F2
с С12 при 270 °С или с NOF·3HF при 200 °С; HgF2-фторирующий
агент в орг. синтезе, в произ-ве гексафторпропиле-на, катализатор фторирования
орг. соединений.
Дихлорид (сулема) HgCl2:
т. кип. 302 °С; температурная зависимость давления пара lgp (мм рт.
ст.) = 4580/Г-- 2,01gT+ 16,39 (298-550 К); безводный HgCl, устойчив на воздухе;
р-римость (г в 100 г): в воде-4,66 (0 °С), 6,59 (20 °С), 10,20 (40°С),
17,37 (60°С), 48 (100°С), этаноле-33 (25°С), в диэтиловом эфире-4
(20°С), раств. в пиридине, уксусной к-те; в водных р-рах практически не
диссоциирует; при кипении водных р-ров увлекается парами воды; степень гидролиза
в 0,0078 М р-ре 1,4% (25 °С). С NH3 образует соед.
Hg2NCl·H2O, HgNH2Cl, а при избытке NH4C1-[Hg(NH3)]Cl2;
последние два соед. наз. соотв. неплавким и плавким белыми преципитатами. Преципитаты
раств. в разб. к-тах, медленно разлагаются в воде с отщеплением NH3;
ядовиты; их применяют как антисептики, компоненты лек. ср-в и косметич. препаратов.
Дихлорид HgCl2 применяют как антисептик, протраву для семян, катализатор
в орг. синтезе, для синтеза ртутьорг. соед., для дубления кожи, как добавку
в электролит марганцевоцинковых элементов.
Дибромид HgBr2:
т.кип. 319°С; р-римость (г в 100 г): в воде-0,55 (20°С), 1,26 (50°С),
4,9 (100°С), этаноле-27,3 (0°С), 28,6 (20 °С), 42,3 (60 °С),
метаноле-53,5 (10 °С), 65,3 (20 °С), 85,1 (60 °С), глицерине-15,7
(25 °С), пиридине-24 (10 °С), 39,6 (30 °С); раств. в ацетоне, бензоле,
CS2, плохо-в диэтиловом эфире; расплавл. HgBr2 хорошо
растворяет многие неорг. и орг. в-ва; применяют как катализатор в орг. синтезе,
как добавку в электролит при очистке ртути, при изготовлении катодов концентрац.
преобразователей тока.
Дииодид HgI2
образует три кристаллич. модификации: ромбич. желтую, тетрагон. красную и тетрагон.
оранжевую. Оранжевая форма переходит в красную при 96 °С (1000 МПа), красная
в желтую при 127 °С (DH перехода 2,59 кДж/моль). Желтая модификация:
т. пл. 256 °С (0,01 МПа); плота. 6,094 г/см3 (127 °С);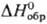 —102,84 кДж/моль,
—102,84 кДж/моль,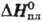 18,8
кДж/моль; очень плохо раств. в
горячей и холодной воде, этаноле, раств. в диэтиловом эфире, р-рах KI и Na2S2O3.
Красная модификация: т.пл. 394 °С (1140 МПа); плотн. 6,48 г/см3
(25 °С); 18,8
кДж/моль; очень плохо раств. в
горячей и холодной воде, этаноле, раств. в диэтиловом эфире, р-рах KI и Na2S2O3.
Красная модификация: т.пл. 394 °С (1140 МПа); плотн. 6,48 г/см3
(25 °С);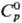 78,3 ДжДмоль · К);
78,3 ДжДмоль · К); 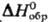 -105,5 кДж/моль,
-105,5 кДж/моль,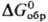 -103,10 кДж/моль;
-103,10 кДж/моль;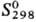 184,13 ДжДмоль · К); р-римость (г в
100 г): в воде-0,004 (17,5 °С), этаноле -2,19 (26°С), метаноле-3,16
(19,5°С), 6,51 (60°С), ацетоне-2,1 (25°С); раств.
в диэтиловом эфире, бензоле, диоксане, пиридине, хлороформе, р-ре KI. Оранжевая
модификация: плотн. 7,70 г/см3; очень плохо раств. в воде, раств.
в р-рах KI, NH3, не раств. в этаноле и эфире.
Т. кип. HgI2 353 °С,
184,13 ДжДмоль · К); р-римость (г в
100 г): в воде-0,004 (17,5 °С), этаноле -2,19 (26°С), метаноле-3,16
(19,5°С), 6,51 (60°С), ацетоне-2,1 (25°С); раств.
в диэтиловом эфире, бензоле, диоксане, пиридине, хлороформе, р-ре KI. Оранжевая
модификация: плотн. 7,70 г/см3; очень плохо раств. в воде, раств.
в р-рах KI, NH3, не раств. в этаноле и эфире.
Т. кип. HgI2 353 °С,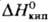 60,3 кДж/молъ.
60,3 кДж/молъ.
Желтую модификацию получают
осаждением иодидом Na из спиртового р-ра HgCl2 при быстром разбавлении
водой, красную - взаимод. I2 с Hg или KI с HgCl2. Применяют
HgI2 как добавку в электролит при изготовлении катодов концентрац.
преобразователей тока, для получения реактива Несслера, а также К2
[HgI4] и Ba[HgI4], р-ры к-рых используют в качестве тяжелых
жидкостей при разделении минералов по плотностям.
Р.г. токсичны, ПДК (в пересчете
на Hg) в воздухе рабочей зоны 0,2 мг/м3, в атм. воздухе 0,0003 мг/м3,
в воде водоемов 0,001 мг/л.
===
Исп. литература для статьи «РТУТИ ГАЛОГЕНИДЫ»: Бродский А.
И., Электрохимия и термодинамика растворов, Избр. труды, т. 1, К., 1974, с.
113-23; Фурман А. А., Неорганические хлориды, М., 1980. См. также лит. при ст.
Ртуть. · Л. Ф. Козин.
Страница «РТУТИ ГАЛОГЕНИДЫ» подготовлена по материалам химической энциклопедии.
|

