|
САМАРИЙ (обнаружен
в минерале самарските, названном в честь рус. геолога В. Е. Самарского-Быховца;
лат. Samarium) Sm, хим. элемент III гр. периодич. системы; относится к редкоземельным
элементам (цериевая подгруппа лантаноидов); ат.н. 62, ат.м. 150,36. Природный
С. состоит из стабильных изотопов 144Sm (3,09%), 148Sm
(11,27%), 149Sm (13,82%), 150Sm (7,47%). 152Sm
(26,63%), 154Sm (22,53%) и радиоактивного изотопа l47Sm
(15,07%, T1/2 1,3·1011 лет, a-излучатель).
Поперечное сечение захвата тепловых нейтрр-нов для прир. смеси изотопов 5,6·10-25
м2. Конфигурация внеш. электронных оболочек атома 4f6
5s2 5p6 6s2; степени окисления
+ 3, + 2 и, вероятно, + 4; энергии ионизации при последоват. переходе
от Sm0 к Sm5+ соотв. 5,63, 11,07, 23,43, 41,37, 62,7 эВ;
электроотрицательность по Полингу 1,0-1,2; атомный радиус 0,181 нм, ионные радиусы
(в скобках даны координац. числа) Sm2+ 0,136 нм (7), 0,141 нм (8),
0,146 нм (9), Sm3+ 0,110 нм (6), 0,116 нм (7), 0,122 нм (8), 0,127
нм (9), 0,138 нм (12).
Содержание в земной коре
7·10-4% по массе, в морской воде 2,3·10-6 мг/л. Вместе
с др. РЗЭ содержится в минералах монаците, бастнезите (0,7-1,3% в пересчете
на Sm2O3), лопарите, самарските, гадолините, ортите и
некоторых др.
Свойства. С.-серебристо-желтый
металл; a-Sm имеет три-гон. кристаллич. решетку, а = 0,8996 нм,
a = 23,21°, z = 3, пространств. группа 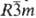 ;
b-Sm кристаллизуется в кубич. решетке тина a-Fe, а = 0,407
нм, z = 2, пространств. группа Iт3т; т-ра перехода
a ;
b-Sm кристаллизуется в кубич. решетке тина a-Fe, а = 0,407
нм, z = 2, пространств. группа Iт3т; т-ра перехода
a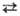 b
917°С, DH перехода 3,1 кДж/моль; т.пл. 1072°С, т.кип. 1788°С;
плотн. a-Sm 7,536 г/см3, плотн. b-Sm 7,40 г/см3; b
917°С, DH перехода 3,1 кДж/моль; т.пл. 1072°С, т.кип. 1788°С;
плотн. a-Sm 7,536 г/см3, плотн. b-Sm 7,40 г/см3;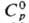 29,5
Дж/(моль·К); 29,5
Дж/(моль·К); 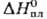 191,2 кДж/моль.
191,2 кДж/моль. 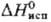 166,6 кДж/моль;
166,6 кДж/моль; 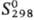 69,5 Дж/(моль·К);
давление пара 4,18 Па (1072 °С); r 5,2·10-7 Ом·м (73 К);
точка Нееля 14 К; твердость по Бринеллю 450-600 МПа. Легко поддается механической
обработке.
69,5 Дж/(моль·К);
давление пара 4,18 Па (1072 °С); r 5,2·10-7 Ом·м (73 К);
точка Нееля 14 К; твердость по Бринеллю 450-600 МПа. Легко поддается механической
обработке.
На воздухе С. окисляется
медленно, при нагр. во влажном воздухе быстрее. С минер. к-тами бурно реагирует,
кипящей водой окисляется, взаимод. с галогенами, халькогенами, N2,
Н2 при нагревании. В водных средах существует в виде производных
Sm(III); в присут. сильных восстановителей способен переходить в Sm(II). В неводных
средах и в твердых дигалогенидах Sm2+ относительно устойчив. Дигалогениды
С. образуются при действии Н2 или металлич. Sm на SmF3 или
SmCl3; Sm2+ существует также в расплавах галогенид-ных
смесей, содержащих металлический С.
Сесквиоксид Sm2O3-желтые
кристаллы с кубич. решеткой типа Тl2О3 (а = 1,0932
нм, z = 16, пространств. группа Ia3); известна моноклинная модификация
B-Sm2O3 (а = 1,4177 нм, b = 0,3633
нм, с = 0,8847 нм, b = 99,96 °, z = 6, пространств. группа
С2/m), существующая выше 875 °С; т.пл. 2270 °С; 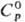 114,5 ДжДмоль · К);
114,5 ДжДмоль · К); 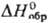 — 1822,6 кДж/моль,
— 1822,6 кДж/моль,
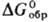 — 1734,4 кДж/моль; — 1734,4 кДж/моль;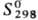 151 Дж/(моль·К); получают
разложением нитратов, сульфатов, оксалатов или др. кислородсодержащих соед.
Sm на воздухе при 800-1000 °С; входит в состав разл. оксидных материалов,
в т.ч. стекол, керамик, люминофоров и др. Временно допустимая концентрация в
воздухе рабочей зоны 6,0 мг/м3 (класс опасности 3).
151 Дж/(моль·К); получают
разложением нитратов, сульфатов, оксалатов или др. кислородсодержащих соед.
Sm на воздухе при 800-1000 °С; входит в состав разл. оксидных материалов,
в т.ч. стекол, керамик, люминофоров и др. Временно допустимая концентрация в
воздухе рабочей зоны 6,0 мг/м3 (класс опасности 3).
Трифторид SmF3-светло-желтые
кристаллы. Существует в двух кристаллич. модификациях: с тритон. решеткой типа
a-LaF3 (а = 0,6962 нм, с = 0,7128 нм, z
= 6, пространств. группа Р3Сl, плотн. 6,90 г/см3)
и с ромбической типа Fe3C (а = 0,6669 нм, b = 0,7059
нм, с = 0,4405 нм, z = 4, пространств. группа Рпта, плотн.
6,64 г/см3); т-ра полиморфного перехода 490 °С; т. пл. 1305 °С;
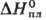 52,5 кДж/моль, 52,5 кДж/моль,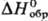 -1668,9 кДж/моль;
получают осаждением из р-ров солей Sm(III) фтористоводородной к-той, фторированием
Sm2O3 при нагр. и др. способами; применяют при получении
чистого С. металлотермич. способом, как микродобавку при произ-ве фторидных
стекол.
-1668,9 кДж/моль;
получают осаждением из р-ров солей Sm(III) фтористоводородной к-той, фторированием
Sm2O3 при нагр. и др. способами; применяют при получении
чистого С. металлотермич. способом, как микродобавку при произ-ве фторидных
стекол.
Три хлорид SmCl3-бледно-желтые
кристаллы с гекса-гон. решеткой типа UC13 (а = 0,7378 нм,
с = 0,4171 нм, z = 2, пространств. группа Р63/m);
т. пл. 678°С;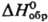 -1028 кДж/моль,
-1028 кДж/моль, 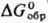 -942 кДж/моль;
-942 кДж/моль;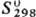 113 Дж/(моль·К); образует
кристаллогидраты; получают взаимод. смеси С12 и СС14 с
Sm2O3 или оксалатом С. выше 200 °С, обработкой SmCl3·nH2O
тионилхлоридом при кипячении с послед. возгонкой; безводный хлорид применяют
для металлотермич. получения С., гидраты-для получения др. соединений С.
113 Дж/(моль·К); образует
кристаллогидраты; получают взаимод. смеси С12 и СС14 с
Sm2O3 или оксалатом С. выше 200 °С, обработкой SmCl3·nH2O
тионилхлоридом при кипячении с послед. возгонкой; безводный хлорид применяют
для металлотермич. получения С., гидраты-для получения др. соединений С.
Получение. Концентрат,
содержащий Sm, Eu, Gd, Tb и нек-рые др. РЗЭ, разделяют зкстракцией, ионообменной
сорбцией или же комбинир. методом (вместе с селективным восстановлением Еu).
С. из полученных таким образом р-ров осаждают в виде карбоната или оксалата
и затем прокаливают до Sm2O3.
Осн. метод получения металлического
С.-металлотермич. восстановление Sm2O3 лантаном или мишметаллом
в вакууме при 1600°С. Используют также карботермич. метод восстановления
Sm2O3.
Наиб. значение для техники
имеет металлический С. Его используют в произ-ве постоянных магнитов в виде
сплавов с Со состава SmCo5 и SmCo17 (см. Магнитные
материалы). С. применяют для активации оксидных катодов, в произ-ве
люминофоров, синтетич. железных гранатов, спец. стекол, керамич. конденсаторов,
катализаторов, пигментов и др.
С. впервые выделил П. Лекок
де Буабодран в 1879.
Лит. см. пря ст.
Редкоземельные элементы.
Л. И. Мартыненко, С.
Д. Моисеев, Ю. М. Киселев.
===
Исп. литература для статьи «САМАРИЙ»: нет данных
Страница «САМАРИЙ» подготовлена по материалам химической энциклопедии.
|

