|
СВИНЕЦ (Plumbum)
Pb, хим. элемент IV гр. периодич. системы, ат. н. 82, ат. м. 207,2. Природный
С. состоит из пяти стабильных изотопов: 202Рb (следы), 204Рb
(1,5%), 206Рb (23,6%), 207Рb (22,6%) и 208Рb
(52,3%). Последние три изотопа-конечные продукты радиоактивного распада соотв.
U, Ас и Th. В природе образуются и радиоактивные изотопы: 209Рb,
210Рb, 211Рb, 212Рb, 214Рb. Поперечное
сечение захвата тепловых нейтронов прир. смеси ок. 0,2·10-28 м2;
хороший поглотитель рентгеновского и g-из-лучения. Конфигурация внеш. электронной
оболочки атома 6s26p2; степени окисления
+2 (наиб. характерна) и +4; энергии ионизации Рb0 : Рb+
: Рb2+ равны соотв. 7,41678 и 15,0320 эВ; работа выхода электрона
4,05 эВ; электроотрицательность
по Полингу 1,55; атомный радиус 0,175 нм, ионные радиусы (нм, в скобках даны
координац. числа) Рb4+ 0,079 (4), 0,092 (6), Рb2+ 0,112
(4), 0,133(6).
Содержание С. в земной
коре 1,6-10 3% по массе, в водах Мирового океана 0,03 мкг/л (41,1
млн. т), в речных водах 0,2-8,7 мкг/л. Известно ок. 80 минералов, содержащих
С., главнейший из них-галенит, или свинцовый блеск, PbS. Небольшое пром. значение
имеют англезит PbSO4 и церус-сит РbСО3. В рудах С. сопутствуют
Сu, Zn; Cd, благородные металлы, Bi, Те и др. ценные элементы. Прир. фон в атмосфере
2·10-9-5·10-4 мкг/м3. В теле взрослого человека
содержится 7-15 мг С.
Свойства. С.-металл синевато-серого
цвета, кристаллизуется в гранецентрир. кубич. решетке типа Сu, а — = 0,49389
нм, z = 4, пространств. группа Fm3m. С.-один
из легкоплавких металлов, тяжелый цветной металл; т. пл. 327,50 °С, т. кип.
1751 °С; плотн., г/см3: 11,3415 (20 °С), 10,686 (327,6 °С),
10,536 (450 °С), 10,302 (650 °С), 10,078 (850 °С); 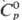 26,65 Дж/(моль · К);
26,65 Дж/(моль · К); 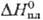 4,81 кДж/моль,
4,81 кДж/моль,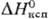 177,7 кДж/моль;
177,7 кДж/моль;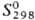 64,80
ДжДмоль · К); давление пара, Па: 4,3·10-7 (600 К), 9,6·10-5
(700 К), 5,4·10-2 (800 К). 1,2·10-1 (900 К), 59,5 (1200
К), 8,2·102 (1500 К), 12,8·103 (1800 К). С.-плохой проводник
тепла и электричества; теплопроводность 33,5 Вт/(м·К) (менее 10% от теплопроводности
Ag); температурный коэф. линейного расширения С. (чистотой 99,997%) в интервале
т-р 0-320 °С описывается ур-нием: a = 28,15·10-6t
+ 23,6·10-9t2 °C-1; при 20°С
r 20,648 мкОм·см (менее 10% от r Ag), при 300 °С и 460 °С
соотв. 47,938 и 104,878 мкОм·см. При -258,7°С r С. падает до 13,11·10
-3 мкОм·см; при 7,2 К он переходит в сверхпроводящее состояние. С.
диамагнитен, магн. восприимчивость —0,12·10-6. В жидком состоянии
С. жидкотекуч, h в интервале т-р 330-800 °С изменяется в пределах 3,2-1,2
мПа·с; g в интервале 330-1000 °С находится в пределах (4,44-4,01)·10-3
Н/м. 64,80
ДжДмоль · К); давление пара, Па: 4,3·10-7 (600 К), 9,6·10-5
(700 К), 5,4·10-2 (800 К). 1,2·10-1 (900 К), 59,5 (1200
К), 8,2·102 (1500 К), 12,8·103 (1800 К). С.-плохой проводник
тепла и электричества; теплопроводность 33,5 Вт/(м·К) (менее 10% от теплопроводности
Ag); температурный коэф. линейного расширения С. (чистотой 99,997%) в интервале
т-р 0-320 °С описывается ур-нием: a = 28,15·10-6t
+ 23,6·10-9t2 °C-1; при 20°С
r 20,648 мкОм·см (менее 10% от r Ag), при 300 °С и 460 °С
соотв. 47,938 и 104,878 мкОм·см. При -258,7°С r С. падает до 13,11·10
-3 мкОм·см; при 7,2 К он переходит в сверхпроводящее состояние. С.
диамагнитен, магн. восприимчивость —0,12·10-6. В жидком состоянии
С. жидкотекуч, h в интервале т-р 330-800 °С изменяется в пределах 3,2-1,2
мПа·с; g в интервале 330-1000 °С находится в пределах (4,44-4,01)·10-3
Н/м.
С. мягок, пластичен, легко
прокатывается в тончайшие листы. Твердость по Бринеллю 25-40 МПа; sраст
12-13 МПа, sсж ок. 50 МПа; относит. удлинение при разрыве 50-70%.
Значительно повышают твердость и прочность С. Na, Ca и Mg, но уменьшают его
хим. стойкость. Медь увеличивает антикоррозионную стойкость С. (к действию H2SO4).
С добавкой Sb возрастает твердость, а также кислотоупорность С. по отношению
к H2SO4. Понижают кислотоупорность С. Bi и Zn, a Cd, Те
и Sn повышают твердость и сопротивление усталости С. В С. практически не раств.
N2, CO, CO2, O2, SO2, H2.
В хим. отношении С. довольно
инертен. Стандартный электродный потенциал С. —0,1265 В для Рb0/Рb2+.
В сухом воздухе не окисляется, во влажном-тускнеет, покрываясь пленкой оксидов,
переходящей в присут. СО2 в основной карбонат 2РbСО3·Рb(ОН)2.
С кислородом С. образует ряд оксидов: Рb2О, РbО (глет), РbО2,
Рb3О4 (сурик) и Рb2О3 (см. Свинца
оксиды). При комнатной т-ре С. не реагирует с разб. серной и соляной
к-тами, т. к. образующиеся на его пов-сти труднорастворимые пленки PbSO4
и РbС12 препятствуют дальнейшему растворению металла. Конц. H2SO4
(>80%) и НС1 при нагр. взаимод. со С. с образованием р-римых соед.
Pb(HSO4)2 и Н4[РbСl6]. С. устойчив
по отношению к фтористоводородной к-те, водным р-рам NH3 и щелочей
и к мн. орг. к-там. Лучшие р-рители С.-разб. HNO3 и СН3СООН.
При этом образуются свинца нитрат Pb(NO3)2 и свинца
ацетат Рb(СН3СОО)2. С. заметно раств. также в лимонной,
муравьиной и винной к-тах.
Соли Pb(IV) м. б. получены
электролизом подкисленных H2SO4 р-ров солей Pb(II); важнейшие
из них-свинца сульфат Pb(SO4)2 и ацетат Рb(ОСОСН3)4.
Соли С. легко гидро-лизуются. Рb -энергичный окислитель, поэтому, напр., не
существуют РbI4 и РbВr4. При разряде свинцового аккумулятора
Рb4+ также служит окислителем:
Рb + РbO2 +
2H2SO4 :2PbSO4 + 2Н2О
При взаимод. оксидов Pb(IV)
и Pb(II) с расплавами щелочей образуются соли-соотв. плюмбаты(IV) и плюмбиты(II),
напр. Na2PbO3,
Na2PbO2. С. медленно раств. в конц. р-рах щелочей с выделением
Н2 и образованием М4[Рb(ОН)6].
При нагревании С. реагирует
с галогенами, образуя свинца галогениды. С азотистоводородной к-той С.
дает свинца азид Pb(N3)2, с серой при нагр.- сульфид
PbS (см. Свинца халь-когениды). Гидриды для С. не характерны. В нек-рых
р-циях обнаруживают тетрагидрид РbН4-бесцв. газ, легко разлагающийся
на Рb и Н2; образуется при действии разб. соляной к-ты на Mg2Pb.
См. также Свинца титанат, Сви-нецорганические соединения.
Получение. Осн.
источник получения С.-сульфидные по-лиметаллич. руды. Селективной флотацией
из руд, содержащих 1-5% Рb, получают свинцовые и др. концентраты. Свинцовый
концентрат обычно содержит 40-75% Рb, 5-10% Zn, до 5% Сu, а также благородные
металлы и Bi. Ок. 90% С. получают по технологии, включающей стадии: агломерирующий
обжиг сульфидных концентратов, шахтная восстановит. плавка агломерата и рафинирование
чернового С. Разрабатывают автогенные процессы плавки, позволяющие использовать
тепло сгорания сульфидов.
Агломерирующий обжиг при
традиц. произ-ве С. проводят на прямолинейных машинах с дутьем воздуха либо
путем просасывания его. При этом PbS окисляется преим. в жидком состоянии: 2PbS
+ 3О2 : 2РbО + 2SO2. В шихту добавляют флюсы (SiO2,
CaCO3, Fe2O3), к-рые, реагируя между собой
и с РbО, образуют жидкую фазу, цементирующую шихту. В готовом агломерате С.
в осн. концентрируется в свинцовосиликатном стекле, занимающем до 60% объема
агломерата. Оксиды Zn, Fe, Si, Ca кристаллизуются в форме сложных соед., образуя
жаропрочный каркас. Эффективная (рабочая) площадь агломерац. машин 6-95 м2.
В готовом агломерате содержится
35-45% Рb и 1,2-3% S, часть к-рой находится в виде сульфатов. Производительность
агломерац. машин по агломерату зависит от содержания S в шихте и колеблется
от 10 (бедные концентраты) до 20 т/(м2 · сут) (богатые концентраты);
по выжигаемой S она находится в пределах 0,7-1,3 т/(м2· сут). Часть
газов, содержащих 4-6% SO2, используют для произ-ва H2SO4.
Степень утилизации S составляет 40-50%.
Полученный агломерат направляют
на восстановит. плавку в шахтных печах. Печь для выплавки С. представляет собой
шахту прямоугольного сечения, образуемую водо-охлаждаемыми коробками (кессонами).
Воздух (или воздушно-кислородная смесь) подается в печь через спец. сопла (фурмы),
расположенные по всему периметру печи в ниж. ряду кессонов. В шихту плавки входят
в осн. агломерат и кокс, иногда загружают кусковое оборотное и вторичное сырье.
Уд. проплав агломерата 50-80 т/(м2 · сут). Прямое извлечение С. в
черновой металл 90-94%.
Цель плавки-максимально
извлечь С. в черновой металл, a Zn и пустую породу вывести в шлак. Осн. р-ция
шахтной плавки свинцового агломерата: РbОрасплав + СО : Рb
+ + СО2. В качестве восстановителя в шихту вводят кокс. Часть
С. восстанавливается им непосредственно. Для восстановления С. требуется слабовосстановит.
атмосфера (давление О2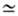 10-6-10-8
Па). Расход кокса к массе агломерата при шахтной плавке 8-14%. В этих условиях
оксиды Zn и Fe не восстанавливаются и переходят в шлак. Медь присутствует в
агломерате в форме СuО и CuS. Оксид меди в условиях шахтной плавки легко восстанавливается
до металла и переходит в С. При высоком содержании Си и S в агломерате при шахтной
плавке образуется самостоят. фаза-штейн. 10-6-10-8
Па). Расход кокса к массе агломерата при шахтной плавке 8-14%. В этих условиях
оксиды Zn и Fe не восстанавливаются и переходят в шлак. Медь присутствует в
агломерате в форме СuО и CuS. Оксид меди в условиях шахтной плавки легко восстанавливается
до металла и переходит в С. При высоком содержании Си и S в агломерате при шахтной
плавке образуется самостоят. фаза-штейн.
Осн. шлакообразующие компоненты
шлаков (80-85% от массы шлака) - FeO, SiO2, CaO и ZnO-направляются
на дальнейшую переработку для извлечения Zn. В шлак переходит до 2-4% Рb и ~20%
Си, содержание в нем этих металлов соотв. 0,5-3,5 и 0,2-1,5%. Образующаяся при
шахтной плавке (и агломерации) пыль служит исходным сырьем для извлечения редких
и рассеянных элементов.
В основе автогенных процессов
выплавки С. лежит экзо-термич. р-ция PbS + О2 : Рb + SO2,
состоящая из двух стадий:
2PbS + 3O2:2PbO
+ 2SO2 PbS + 2РbО:3Рb + SO2
Преимущества автогенных
способов перед традиц. техно-логией: исключается агломерац. обжиг, устраняется
необходимость разбавления концентрата флюсами, что снижает выход шлака, используется
тепло от горения сульфидов и исключается (частично) расход кокса, повышается
извлечение SO2 с газами, что упрощает их использование и повышает
безопасность на заводе. В пром-сти применяют два автогенных процесса: КИВЦЭТ-ЦС,
разработанный в СССР и осуществленный на Усть-Каменогорском заводе и в Италии
на заводе Порто-Весме, и американский процесс QSL.
Технология плавки по методу
КИВЦЭТ-ЦС: тонкоизмельченную, хорошо высушенную шихту, содержащую концентрат,
оборотную пыль и кокс, с помощью горелки инжектируют техническим О2
в плавильную камеру печи, где происходит окисление сульфидов металлов, получение
С. и формирование шлака. Газы (содержат 20-40% SO2) после очистки
от пыли, возвращаемой в шихту плавки, поступают на произ-во H2SO4.
Черновой С. и шлак через разделит. перегородку протекают в электротермич. печь-отстойник,
откуда их выпускают через летки. Кокс подают в шихту для восстановления избыточного
оксида С. в плавильной зоне.
Процесс QSL проводят в
агрегате типа конвертера. Печь разделена перегородкой на зоны. В плавильной
зоне происходит загрузка гранулир. концентрата, плавка и окисление расплава
техническим О2. Шлак поступает во вторую зону, где с помощью фурм
он продувается пылеугольной смесью для восстановления С. Во всех способах плавки
осн. кол-во Zn (~80%) переходит в шлак. Для извлечения Zn, а также оставшегося
С. и нек-рых редких и рассеянных элементов шлак перерабатывают способом фьюмингования
или вальцевания.
Черновой С., полученный
тем или иным способом, содержит 93-98% Рb. Примеси в черновом С.: Сu (1-5%),
Sb, As, Sn (0,5-3%), Аl (1-5 кг/т), Аu (1-30%), Bi (0,05-0,4%). Очистку
чернового С. производят пирометаллургически или (иногда) электролитически.
Пирометаллургич. методом
из чернового С. последовательно удаляют: 1) медь-двумя операциями: ликвацией
и с помощью элементарной S, образующей сульфид Cu2S. Предварит. (грубую)
очистку от Си до содержания 0,5-0,7.% проводят в отражательных либо электротермических
печах с глубокой свинцовой ванной, имеющей перепад т-ры по высоте. Медь взаимод.
на пов-сти с сульфидным свинцовым концентратом с образованием Cu-Pb штейна.
Штейн направляют в медное произ-во либо на самостоят. гидроме-таллургич. переработку.
2) Теллур-действием металлич.
Na в присут. NaOH. Натрий селективно взаимод. с Те, образуя Na2Te,
всплывающий на пов-сть ванны и растворяющийся в NaOH. Плав идет на переработку
для извлечения Те.
3) Олово, мышьяк и сурьму-окислением
их либо О2 воздуха в отражат. печах при 700-800 °С, либо NaNO3
в присут. NaOH при 420 °С. Щелочные плавы направляют на гидрометаллургич.
переработку для регенерации из них NaOH и извлечения Sb и Sn; As выводят в виде
Ca3(AsO4)2, к-рый направляют на захоронение.
4) Серебро и золото-с помощью
Zn, избирательно реагирующего с растворенными в С. благородными металлами; образуются
AuZn3, AgZn3, всплывающие на пов-сть ванны. Образовавшиеся
съемы удаляют с пов-сти для послед. переработки их на сплав Ag-Au. На этой стадии
С. загрязняется Zn (0,5-0,8%).
5) Цинк-окислением воздухом
либо NaNO3 в щелочном расплаве, хлорированием, а также отгонкой в
вакууме.
6) Висмут-действием Са,
Mg, Sb. Предварительно вводят в ванну Са и Mg, при этом образуется Bi2CaMg2,
а в С. остается 0,008-0,01% Bi; затем добавляют в ванну, наряду с Са и Mg, также
Sb, при этом в С. остается 0,006-0,004% Bi. Полученные на предварит. стадии
богатые съемы (дроссы) направляют
на переработку для извлечения из них Bi. В свинцовой ванне остаются Са, Mg,
Sb.
7) Примеси Са, Mg, Sb и
Zn удаляют окислением NaNO3 в присут. NaOH либо хлорированием.
Рафинирование С. осуществляют
в стальных котлах полу-сферич. формы емкостью 50-300 т с открытой пов-стью ванны.
Готовый С. разливают в чушки (~ 30 кг) либо блоки (~1 т). При электролитич.
рафинировании чернового С'Г в качестве электролита используют водный р-р фторосили-ката
С. (8-10% H2SiF6, 6-8% PbSiF6). Черновой С.
предварительно рафинируют (пирометаллургически) от Sn и Си. Электролиз проводят
при напряжении на ванне 0,4-0,7 В, плотн. тока 130-180 А/м2 и т-ре
электролита 40-50 °С. Выход С. по току составляет 90-97%. Примеси С. концентрируются
в анодном шламе.
Определение. С. определяют:
по изменению степени мутности р-ра, образующегося при взаимод. Рb2+
с К2СrО4; колориметрически с дитизоном, амперометрич.
титрованием с молибдатом аммония; спектрометрически с диэтилди-тиокарбаматом
Na и 8-гидроксихинолином; хроматогра-фически.
Применение. До 45% С. от
общего потребления идет на произ-во электродов аккумуляторов; до 20%-на изготовление
проводов и кабелей и покрытий к ним; 5-20% С.-на произ-во тетраэтилсвинца.
С. используют для изготовления футеровки, труб и аппаратуры в хим. пром-сти.
Применяют свинца сплавы с Sn, Са, содержащие Sb, Cu, As, Cd. В стр-ве
С. используют в качестве изоляции, уплотнителя швов, стыков, в т.ч. при создании
сейсмостойких фундаментов. В военной технике С. применяют для изготовления шрапнели
и сердечников пуль. Экраны из С. служат для защиты от радиоактивного и рентгеновского
излучений.
По объему произ-ва и потребления
С. занимает четвертое место среди цветных металлов после А1, Си и Zn. Произ-во
С. в капиталистич. и развивающихся странах ок. 4,0 млн. т/год (1983). Осн. производители
и потребители: США, ФРГ, Великобритания, Япония, Канада и Австралия.
С. был известен за 6-7
тыс. лет до н.э. народам Месопотамии, Египта и др. стран древнего мира.
С.-яд, вызывает профессиональные
отравления. ПДК в воздухе рабочей зоны 0,01 мг/м3, атм. воздухе 0,003
мг/м3, воде 0,03 мг/л, почве 20,0 мг/кг. Осн. источники загрязнения
С. окружающей среды: металлургич. предприятия (ежегодный выброс не менее 89
тыс.т), выхлопные газы двигателей внутр. сгорания (до 260 тыс. т/год), сточные
воды пром. предприятий (выброс в Мировой океан 430-650 тыс. т/год) и др.
===
Исп. литература для статьи «СВИНЕЦ»: Гудима Н.В.,
Шейн Я. П., Краткий справочник по металлургии цветных металлов, М., 1975; Смирнов
М. П., Рафинирование свинца и переработка полупродуктов, М., 1977; Рабинович
В. А., Хавин З.Я., Краткий химический справочник, Л., 1977; Зайцев В. Я., Маргулис
Е. В., Металлургия свинца и цинка, М., 1985; Козин Л.Ф., Морачевский А. Г.,
Физико-химия и металлургия высокочистого свинца, М., 1991. М.П. Смирнов.
Страница «СВИНЕЦ» подготовлена по материалам химической энциклопедии.
|

