|
СЕЛЕНОФЕН, мол.
м. 131,03; т. пл. -38°С, т. кип. 110,5-111 °С/753 мм рт.ст.;
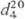 1,5358; 1,5358;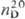 1,5715; давление пара (МПа) 6,3·10-2 (25°С), 1,49·10-2
(50°С), 4,75·10-2 (85°С); m 1,327·10-30 Кл·м.
Молекула плоская.
1,5715; давление пара (МПа) 6,3·10-2 (25°С), 1,49·10-2
(50°С), 4,75·10-2 (85°С); m 1,327·10-30 Кл·м.
Молекула плоская.

С.-ароматич. p-электронная
система с электро-нодонорным гетероатомом. Мало чувствителен к действию к-т,
щелочей, окислителей и восстанови телей; с изатином дает голубое окрашивание
(индо-фениновая р-ция); пикратов, иодметилатов не обра-зует.
С. легче, чем бензол, вступает
в р-ции электроф. (нитрование, сульфирование, галогенирование, ацилирование
и др.) и нуклеоф. (металлирование) замещения. Р-ции идут преим. в положение
2, послед. замещение-преим. в положение 5. С малеиновым ангидридом С. дает двойной
аддукт с выделением Se. Под действием алкиллития раскрывает цикл.
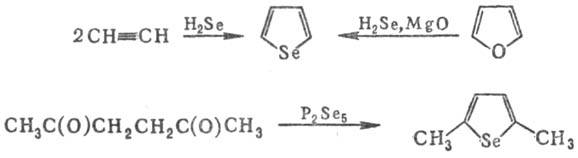
Методы синтеза С. и его
замещенных: взаимод. парафиновых, этиленовых, ацетиленовых или сопряженных диеновых
углеводородов с Se, SeO2, H2Se или (CH3)2Se;
замена гетеро-атома в пятичленных гетероциклах на атом Se, циклизация дикарбонильных
соед. с P2Se5, напр.:
Производные С.-эффективные
высокотемпературные ан-тиоксиданты, экстрагенты для выделения и разделения металлов
(напр., Zr и Hi), физиологически активные соед. (аминоспирты), полимерные материалы
(на основе тетра-замещенных производных С.).
===
Исп. литература для статьи «СЕЛЕНОФЕН»: Общая органическая
химия, пер. с англ., т. 8, М., 1985, с. 340-49; Magdesieva N. N.,
"Adv. Heterocycl. Chem.", 1970, v. 12, p. 1; Hornfeldt А.-В.,
"Adv. Heterocycl. Chem.", 1982, v. 30, p. 127-66. См. также лит.
при ст. Селенорганические соединения. Н. Н. Магдесиева.
Страница «СЕЛЕНОФЕН» подготовлена по материалам химической энциклопедии.
|

