|
СЕРЕБРО (Argentum) Ag, хим. элемент I
гр. периодич. системы, ат. н. 47, ат. м. 107,8682; относится к благородным
металлам. Природное С. состоит из двух стабильных изотопов: 107Ag
(51,35%) и 109Ag (48,65%). Поперечное сечение захвата тепловых нейтронов
для прир. смеси изотопов 6,2·10-27 м2. Конфигурация внеш.
электронных оболочек атома 4s24p64d105s1;
степени окисления + 1 (наиб. устойчива), + 2 и +3; энергии ионизации при
переходе Ag0 : : Ag+ : Ag2+
7,57632, 21,487 эВ; сродство к электрону 1,301 эВ; электроотрицательность по
Полингу 1,93; атомный радиус 0,145 нм, ионные радиусы (в скобках даны координац.
числа), нм: Ag+ 0,100 (4) и 0,115 (6), Ag2+ 0,079 (4)
и 0,094 (6). С.-самый распространенный из благородных металлов, его содержание
в земной коре оценивают в 7·10-6 % по массе, в морской воде -1,5·10-8-2,9·10-7
%, пресной -2,7·10-8 %. Известно более 60 серебросодержащих минералов,
делящихся на 6 групп: самородное С. и сплавы его с Си и Аu; простые сульфиды
С.-акантит и аргентит Ag2S; теллуриды и селениды С.-гессит Ag2Te,
науманит Ag2Se, эвкайрит AgCuSe и др.; антимониды и арсениды С.-дискра-зит
Ag3Sb и др.; галогениды и сульфаты С. - кераргирит AgCl, аргентоярозит
AgFe3(SO4)2(ОН)6 и др.; сложные
сульфиды, или тиосоли, типа nAg2S·mM2S3,
где М = As, Sb, Bi, напр. пираргирит Ag3SbS3, прустит
Ag3AsS3, полибазит (Ag, Cu)16Sb2S11
и т.п. Все минер. месторождения делятся на собственно серебряные руды, в к-рых
содержание С. превышает 50%, и комплексные полиметаллич. руды цветных и тяжелых
металлов с содержанием С. не выше 10-15%. Комплексные месторождения обеспечивают
примерно 80% добычи С. (в качестве побочного продукта переработки сульфидных
руд) в зарубежных странах, причем 40-50% из этого кол-ва С. извлекают из цинковых
руд, по 15-20%-из кобальтовых и медных, а остальное-из сурьмяных и смешанных
руд. Осн. месторождения таких руд сосредоточены в Мексике, Канаде, Австралии,
Перу, США, Боливии и Японии. На долю указанных стран приходится 70-80% добычи
первичного С. Общие запасы С. в развитых и развивающихся странах 505 тыс. т
(1986), в т. ч. подтвержденные 360 тыс. т.
Свойства. С.-белый блестящий
металл, в тонких пленках и проходящем свете-голубого цвета. Кристаллизуется
в гранецентрир. кубич. решетке, а = 0,4086 нм, z = 4, пространств.
группа Fm3m; т. пл. 961,93 °С, т. кип. 2167°С; плотн.
10,491 г/см3; 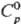 25,36 Дж/(моль·К); DHпл 11,30 кДж/моль, DHисп
251,5 кДж/моль;
25,36 Дж/(моль·К); DHпл 11,30 кДж/моль, DHисп
251,5 кДж/моль; 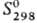 42,55 Дж/(моль·К); ур-ния температурной
зависимости давления пара над жидким С. lgp(aтм) = -1,368·104/Т+
5.615, плотн. жидкого С. d = = 10,465 - 9,67·10-4 Т
г/см3; tкрит 4395°С, pкрит
33,6 МПа и uкрит 339 см3/моль. С. обладает наиб.
теплопроводностью и электрич. проводимостью: r 1,59 (0°С) и 8,4 мкОм·см
(960 °С), теплопроводность 419 (293 К) и 377 Вт/(м·К) при 773 К. Примеси
в С. уменьшают его · теплопроводность и электрич. проводимость. С. диамагнитно,
его магн. восприимчивость (—0,181·10-9) не зависит от т-ры; коэф.
Холла —0,9·1010. С. обладает высокой отражат. способностью: в ИК
диапазоне степень отражения лучей составляет 98%, в видимой области спектра-95%
и снижается до 10% при длине волны 320 нм. С.-мягкий и пластичный металл; предел
текучести составляет 10-50 МПа; твердость по Бринеллю 245-250 МПа, по Виккерсу
148-154 МПа; модуль упругости 82,7 ГПа, модуль сдвига 30,3 ГПа.
42,55 Дж/(моль·К); ур-ния температурной
зависимости давления пара над жидким С. lgp(aтм) = -1,368·104/Т+
5.615, плотн. жидкого С. d = = 10,465 - 9,67·10-4 Т
г/см3; tкрит 4395°С, pкрит
33,6 МПа и uкрит 339 см3/моль. С. обладает наиб.
теплопроводностью и электрич. проводимостью: r 1,59 (0°С) и 8,4 мкОм·см
(960 °С), теплопроводность 419 (293 К) и 377 Вт/(м·К) при 773 К. Примеси
в С. уменьшают его · теплопроводность и электрич. проводимость. С. диамагнитно,
его магн. восприимчивость (—0,181·10-9) не зависит от т-ры; коэф.
Холла —0,9·1010. С. обладает высокой отражат. способностью: в ИК
диапазоне степень отражения лучей составляет 98%, в видимой области спектра-95%
и снижается до 10% при длине волны 320 нм. С.-мягкий и пластичный металл; предел
текучести составляет 10-50 МПа; твердость по Бринеллю 245-250 МПа, по Виккерсу
148-154 МПа; модуль упругости 82,7 ГПа, модуль сдвига 30,3 ГПа.
Из благородных металлов
С.-наиб. реакционноспособно. Тем не менее С. химически мало активно и легко
вытесняется из своих соед. более активными металлами. Углем, Н2 и
др. восстановителями ионы С. восстанавливаются до Ag0. Стандартный
электродный потенциал Ag+/Ag0 0,799 В. При комнатной т-ре
С. не взаимод. с О2 воздуха, но при нагр. до 170°С покрывается
пленкой оксида Ag2O. Озон в присут. влаги окисляет С. до высших оксидов-Ag2O2
и Ag2O3. При взаимод. нагретого С. с S или Н2S
в присут. О2 образуется серебра сульфид Ag2 S.
Халькогены, фосфор, мышьяк и углерод реагируют с нагретым С. с образованием
соответствующих бинарных соединений. С. легко раств. в разб. и конц. HNO3
с образованием серебра нитрата AgNO3. При нагр. Ag раств.
и в конц. H2SO4, давая сульфат Ag2SO4.
Галогены в присут. влаги, а также конц. галогеноводород-ные к-ты медленно реагируют
с металлическим С., давая серебра галогениды AgX. В присут. О2
С. легко раств. в р-рах цианидов щелочных металлов с образованием комплексных
цианидов M1[Ag(CN)2]. Расплавл. щелочи и орг. к-ты не
действуют на металлическое С.
Известны многочисл. комплексные
соединения С., в к-рых координац. число С. равно 2, 3 и 4.
Большинство соед. Ag(I)
плохо раств. в воде, за исключением AgF, AgNO3, AgClO4
и AgClO3. Соли С.-бесцв. или слегка желтоватые в-ва. На свету почти
все соед. Ag(I) разлагаются до свободного С. и при этом окрашиваются в серый
или черный цвет, что используется в фотографии. Соединения С. термодинамически
мало устойчивы, причем углерод- и азотсодержащие соед. Ag(I) способны к разложению
со взрывом.
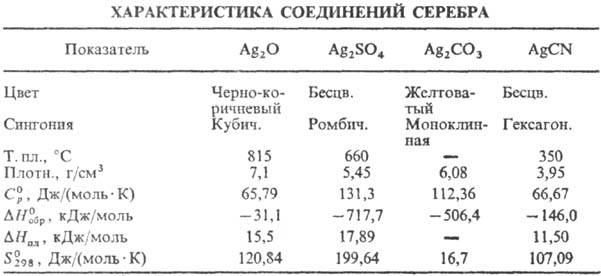
Оксид Ag(I) (гемиоксид)
Ag2O при нагр. выше 100°С разлагается до Ag и О2;
р-римость в воде 1,3·10 3 г в 100 г воды (см. также табл.); водные
р-ры Ag2O имеют щелочную р-цию вследствие частичного образования
AgOH; в водной суспензии легко восстанавливается до металлического С. водородом,
СО, металлами и др. восстановителями; раств. в к-тах, водном NH3,
цианидах и тиосульфатах щелочных металлов с образованием соответствующих простых
и комплексных солей Ag(I); теряет на свету О2; диамагнитен; получают
при обработке р-ра AgNO3 щелочами, применяют в гопкалитовых патронах
противогазов, как окислитель в орг. синтезе; водные р-ры-антисептич. ср-во.
Монооксид Ag2O2 (или AgIAgIIIO2)-серые
кристаллы моноклинной сингонии; разлагается выше 100 °С;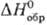 —24,7 кДж/моль; получают окислением С. или Ag2 О озоном, анодным
окислением С., используют для изготовления электродов в серебряно-цинковых элементах
и аккумуляторах.
—24,7 кДж/моль; получают окислением С. или Ag2 О озоном, анодным
окислением С., используют для изготовления электродов в серебряно-цинковых элементах
и аккумуляторах.
Гидроксид AgOH, по непроверенным
сведениям, м.б. получен в виде неустойчивого белого осадка при обработке р-ра
AgNO3 в этаноле спиртовым р-ром КОН при — 45 °С; обладает амфотерными
св-вами с преобладанием диссоциации по щелочному типу; для бесконечно разб.
р-ров 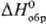 -124,36
кДж/моль, -124,36
кДж/моль, 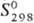 61,70
Дж/(моль · К). 61,70
Дж/(моль · К).
Сульфат Ag2SO4
при 427°С переходит из ромбич. a-модификации в гексагон. b-модификацию,
DH перехода 18,64 кДж/моль; выше 1100°С разлагается до Ag, SO2
и О2; р-римость в воде 0,8 г в 100 г при 20°С; в сернокислотных
р-рах легко восстанавливается FeSO4, Zn и Mg до Ag0; получают
действием конц. H2SO4 на Ag или Ag2O или обменной
р-цией р-римых солей С. с сульфатами металлов, в избытке H2SO4
образуются гидросульфат AgHSO4 и ад-дукты Ag2SO4
c H2SO4.
Карбонат Ag2СО3
выше 120 °С разлагается до Ag, CO2 и О2; р-римость
в воде 3·10-3 г в 100 г, раств. в водном NH3, цианидах
и тиосульфатах щелочных металлов, с карбонатами др. металлов образует двойные
карбонаты; получают действием р-ров карбонатов или гидрокарбонатов металлов
на AgNO3.
Цианид AgCN практически
не раств. в воде (2·10-5 г в 100 г), в водном р-ре с избытком KCN
образует комплексный цианоаргентат K[Ag(CN)2], при действии к-т на
цианоаргентаты выделяется синильная к-та HCN; получают действием р-ров KCN или
NaCN на стехиометрич. кол-во AgNO3; компонент электролитов при гальванич.
серебрении, применяют также в произ-ве нитрилов и изо-нитрилов; ПДК 0,3 мг/м3
(в пересчете на HCN).
Специфич. хим. св-во С.-способность
легко образовывать коллоидное С. в р-ре при восстановлении соединений С. или
при диспергировании компактного металла. Золи С. окрашены в разл. цвета-от фиолетового
до оранжевого—в зависимости от размера частиц металла и способа получения золя.
С. в коллоидном состоянии-энергичный восстановитель, катализатор окисления,
бактерицидный препарат (колларгол, протаргол). Бактерицидные св-ва присущи и
металлическому С.: при концентрации С. в р-ре 40-200 мкг/л погибают неспоровые
бактерии, а при более высоких концентрациях - споровые.
С. хорошо адсорбирует газы,
такие, как Н2, О2, Аr и др. Так, при 500 °С Ag может
поглощать до 5 объемов О2. При охлаждении жидкого С., содержащего
растворенный в нем О2, выделение газа может происходить со взрывом.
С. образует множество интерметаллидов
и сплавов с др. металлами. Так, с Pd и Аu С. дает непрерывный ряд твердых р-ров,
с Сu, Ni и Pb-эвтектич. сплавы, а с остальными металлами - интерметаллиды разл.
состава. Введение металлов в С. часто улучшает его мех. и хим. св-ва.
Получение. Первая стадия
переработки всех серебросо-держащих руд-флотац. и гравитац. обогащение. Дальнейшие
методы выделения С. зависят от типа руды и содержания С. и делятся на пирометаллургич.
и гидрометаллургические. Полиметаллич. сульфидные руды не поддаются прямой гидрометаллургич.
переработке и их вначале подвергают обжигу-окислительному, восстановительному
(или хлорирующему). При обжиге свинцовых руд Ag2S концентрируется
в оксиде Рb и затем в металлич. Рb. Для выделения С. из Рb применяют методы
Паркеса и Паттинсо-на. По методу Паркеса серебросодержащий Рb плавят вместе
с Zn и С. концентрируется в Zn в виде интерметаллидов. После отгонки Zn остаток
купелируют (нагревают в печи в потоке воздуха) и отделяют сырое металлическое
С. от оксидов остальных металлов.
По методу Паттинсона серебросодержащий
Рb медленно охлаждают и при этом вначале кристаллизуется чистый Рb, к-рый отделяют
от расплава; остается сплав Рb с Ag с содержанием С. 2-3%, к-рый перерабатывают
далее купелированием.
При переработке медных
руд после окислит. и восстановит. плавок получают сплавы Сu с Ag, из к-рых С.
выделяют электролизом. Из сплава отливают аноды и при их растворении Си осаждается
на катоде, а С. концентрируется в шламе.
Собственно серебряные руды
перерабатывают после обогащения методом цианирования, для чего руду обрабатывают
в водном р-ре NaCN или KCN в присут. О2 и затем С. извлекают из комплексных
цианидов восстановлением металлами или с использованием анионитов. В осн. история,
интерес представляет сейчас амальгамный метод извлечения С., по к-рому руда
смешивается в р-ре с Hg и хлоридами, при этом образуется амальгама С.; из нее
после отгонки Hg получают сырое С.
Для получения С. высокой
чистоты (99,999%) сырой металл подвергают электролитич. аффинажу в р-ре AgNO3
с осаждением С. на катоде (примеси переходят в шлам).
Все серебросодержащие отходы
пром-сти (отработанные фотоматериалы, контакты, источники питания и т. п.) также
подвергаются переработке с целью извлечения вторичного С., к-рое вновь расходуется
в пром-сти в кол-ве 60-70% от общего потребления С.
Определение. Качественно
С. обнаруживают по цветным р-циям образования комплексов С. с использованием
орг. N- и S-содержащих реагентов (производные роданина, фе-нилтиомочевины, дитизона
и т.п.). Применяют также восстановление С. из р-ра до металла и микрокристаллич.
р-ции образования AgCl, Ag2Cr2O7 и комплекса
С. с уротропином.
Количественно С. определяют
гравиметрически (осаждение С. в виде AgCl или комплекса С. с бензотриазолом),
титриметрически по Фольгарду с использованием р-ров KCNS или NH4CNS
в присут. железо-аммониевых квасцов. Применяют колориметрич. методы с использованием
производных роданина и дитизона, каталиметрич. (основанные на измерении скорости
р-ции в присут. микрокол-в С.), а также эмиссионно-спектральный и атомно-абсорбционный
методы анализа.
Применение. Примерно
30-40% производимого С. расходуют на изготовление кино- и фотоматериалов. Ок.
20% С. в виде сплавов с Pd, Аu, Сu, Zn и др. металлами идет на изготовление
контактов, припоев, проводящих слоев, элементов реле и др. устройств в электротехнике
и электронике. Сплавы С. с Аu и Сu, а также с Hg, Sn, Zn и Си используют в стоматологии
для пломбирования и протезирования. 20-25% С. расходуют на изготовление элементов
питания-серебряно-цинковых аккумуляторов, обладающих высокой энергоемкостью
(космич. и оборонная техника), оксидно-серебряных элементов питания часов и
т.п. Из С. изготовляют монеты, ювелирные изделия, украшения, столовую посуду.
С. используют для серебрения зеркал, аппаратов в пищ. пром-сти, как катализатор
процессов дожигания СО, восстановления NO и р-ций окисления в орг. синтезе.
Объем произ-ва первичного
С. в мире колеблется в зависимости от цен на рынке. В связи с тем, что С.-второй
валютный металл, сведения о масштабах его произ-ва и потребления являются оценочными.
В сер. 80-х гг. произ-во первичного С. в развитых и развивающихся странах оценивалось
в 10-15 тыс. т/год.
ПДК С. в воздухе 0,1-0,5
мг/м3. При попадании р-римых соединений С. на кожу и слизистые оболочки
происходит восстановление С. до серо-черного коллоидного металла. Это окрашивание
пов-сти тканей (аргирия) исчезает в результате растворения и истирания коллоидного
С. вместе с кожей.
С. известно человеку с
древнейших времен, еще в 4-м тыс. до н.э. оно использовалось для изготовления
украшений, служило торговым эквивалентом в странах Востока.
===
Исп. литература для статьи «СЕРЕБРО»: Пятницкий
И. В., Сухан В. В., Аналитическая химия серебра, М., 1975; Малышев В.М., Румянцев
Д. В., Серебро, 2 изд., М., 1987; Silver. Economics, metallurgy and use, Princeton
(N.Y.), 1967; Thompson N. R., в кн.: Masscy A. G., The chemistry of cooper,
Oxf., 1975. П.М. Чукуров.
Страница «СЕРЕБРО» подготовлена по материалам химической энциклопедии.
|

