|
АЦЕТИЛЕН (от лат. acetum-уксус и греч. hyle - лес, дерево; вещество)
(этин) СН СН,
мол. м. 26,04; бесцв. газ; т. пл. -81°С/1277мм рт. ст., т. возг. -84,1°С;
т. кип. -83,8°С; плотн. 1,0896 г/л (газ; 20°С; 101 кПа); СН,
мол. м. 26,04; бесцв. газ; т. пл. -81°С/1277мм рт. ст., т. возг. -84,1°С;
т. кип. -83,8°С; плотн. 1,0896 г/л (газ; 20°С; 101 кПа);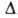 Н°о6р -227,400 кДж/моль (газ; 298,15 К),
Н°о6р -227,400 кДж/моль (газ; 298,15 К),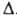 Н°сгор
— 1307 кДж/моль; Сpo 44,036 Дж/(моль*К); давление
пара жидкого А. (МПа): 1,1 (-30°С), 2,6 (0°С), 5,4 (30°С); tкрит 35,2°С,
pкрит 6,4 МПа; макс. т-ра кислородно-ацетиленового пламени 3150°С
(при содержании А. 45% по объему), воздушно-ацетиленовой смеси 2350 °С.
Р-римость (объемы А.) в 1 объеме р-рителя при 15°С и 101 кПа: в воде-1,15;
ацетоне-25 (при 1,2 МПа-300; при -80°С и 0,1 МПа-2000); спирте-6; бензоле-4;
уксусной к-те-6 (18°С); ДМФА -33,5 (25 °С). Н°сгор
— 1307 кДж/моль; Сpo 44,036 Дж/(моль*К); давление
пара жидкого А. (МПа): 1,1 (-30°С), 2,6 (0°С), 5,4 (30°С); tкрит 35,2°С,
pкрит 6,4 МПа; макс. т-ра кислородно-ацетиленового пламени 3150°С
(при содержании А. 45% по объему), воздушно-ацетиленовой смеси 2350 °С.
Р-римость (объемы А.) в 1 объеме р-рителя при 15°С и 101 кПа: в воде-1,15;
ацетоне-25 (при 1,2 МПа-300; при -80°С и 0,1 МПа-2000); спирте-6; бензоле-4;
уксусной к-те-6 (18°С); ДМФА -33,5 (25 °С).
Атомы углерода в А. sp-гибридизованы. Они связаны одной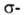 и
двумя и
двумя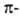 связями,
макс. плотности к-рых расположены в двух взаимно перпендикулярных областях,
образуя цилиндрич. облако связями,
макс. плотности к-рых расположены в двух взаимно перпендикулярных областях,
образуя цилиндрич. облако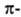 электронной
плотности; за его пределами находятся атомы Н (см. рис.). электронной
плотности; за его пределами находятся атомы Н (см. рис.).
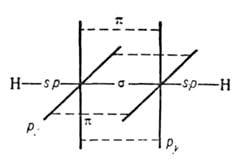
Молекула А. линейна; все 4 атома расположены на прямой. Расстояния С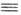 С
и С—Н равны соотв. 0,1205 и 0,1059 нм. Энергия тройной связи 836 кДж/моль.
В ИК-спектрах несимметричной ацетиленовой группы (RC С
и С—Н равны соотв. 0,1205 и 0,1059 нм. Энергия тройной связи 836 кДж/моль.
В ИК-спектрах несимметричной ацетиленовой группы (RC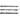 СН)
имеются полосы поглощения валентных колебаний при частотах СН)
имеются полосы поглощения валентных колебаний при частотах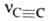 2260-2100 см-1, vС_H 3310-3300 см-1
и деформационных колебаний
2260-2100 см-1, vС_H 3310-3300 см-1
и деформационных колебаний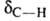 700-610 см'1. В спектрах ЯМР хим. сдвиг протона составляет 2,0
м.д., ядер 13С-68 м.д. (для C2H5G
700-610 см'1. В спектрах ЯМР хим. сдвиг протона составляет 2,0
м.д., ядер 13С-68 м.д. (для C2H5G CH).
Ацетиленовая группа не поглощает УФ-излучение с длиной волны более 200
нм. CH).
Ацетиленовая группа не поглощает УФ-излучение с длиной волны более 200
нм.
Для А. характерны р-ции присоединения, к-рые происходят в две стадии:
сначала образуются замещенные этилена, затем - замещенные алканов. Галогены
присоединяются непосредственно, галогеноводороды - в присут. катализаторов
(напр., CuCl, HgCl2):
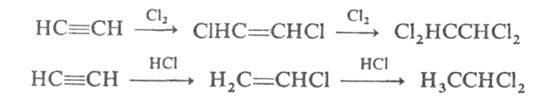
Эти р-ции используются при произ-ве тетрахлорэтилена, трихлорэтилена,
винилхлорида и др. хлорсодержащих соединений.
Водород присоединяется в присут. катализаторов (Ni, Pt или др.): СН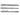 СН
-> СН2=СН2 -> СН3СН3; вода
- в присут. солей Hg2+ с образованием ацетальдегида (Кучерова
реакция). Прямая гидратация происходит при пропускании смеси А. и паров
воды при 300-400°С над фосфатами тяжелых металлов. Гидратация А. используется
в пром-сти для произ-ва ацетальдегида и продуктов дальнейших его превращений
- уксусной к-ты, ацетона, спирта. В присут. CuCl в кислой среде HCN присоединяется
к А. с образованием акрилонитрила. А. легко присоединяет сулему в виде
р-ра в 10-12%-ной соляной к-те: СН
-> СН2=СН2 -> СН3СН3; вода
- в присут. солей Hg2+ с образованием ацетальдегида (Кучерова
реакция). Прямая гидратация происходит при пропускании смеси А. и паров
воды при 300-400°С над фосфатами тяжелых металлов. Гидратация А. используется
в пром-сти для произ-ва ацетальдегида и продуктов дальнейших его превращений
- уксусной к-ты, ацетона, спирта. В присут. CuCl в кислой среде HCN присоединяется
к А. с образованием акрилонитрила. А. легко присоединяет сулему в виде
р-ра в 10-12%-ной соляной к-те:
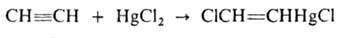
Действием AsCl3 на это соединение получают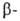 хлорвинилдихлорарсин
(люизит): хлорвинилдихлорарсин
(люизит):
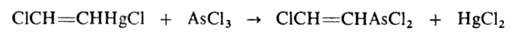
Спирты присоединяются к А. в присут. КОН, BF3 или HgO при
150-200°С Продукты р-ции - простые виниловые эфиры, используемые в произ-ве
полимеров, смазочных масел, эмульгаторов и др. Аналогично к А. могут присоединяться
карбоновые к-ты (кат. - HgSO4, ацетаты Zn или Cd на активиров.
угле), амины, амиды к-т, тиолы и др. с образованием виниловых соед., напр.:
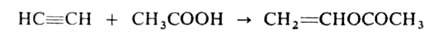
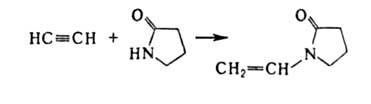
А. легко присоединяет альдегиды и кетоны в присутствии щелочных катализаторов
(реакция Фаворского). Большое практическое значение имеет реакция А. с
формальдегидом в присутствии ацетиленида Си (реакция Реппе):
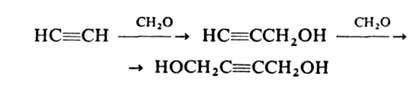
Образующиеся пропаргиловый спирт и 2-бутин-1,4-диол - исходные вещества
в производстве 1,4-бутиленгликоля. При взаимод. А. с СО и спиртами, NH3
или аминами в присут. Ni(CO)4 под давлением получают эфиры или
амиды акриловой кислоты, используемые в синтезе полимеров:
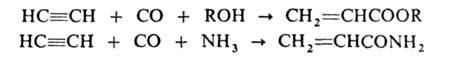
Карбонилирование м. б. использовано также для синтеза бензохинона:
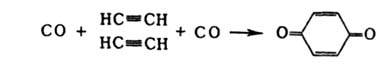
Под влиянием солей Cu(I) в водном НCl А. димеризуется в винилацетилен,
из к-рого получают хлоропрен. Над активным углем А. гладко тримеризуется
в бензол. В присут. Ni(CN)2 в тетрагидрофура не А. превращается
в циклооктатетраен С8Н8 (р-ция Реппе), в присут.
Н2 над Ni - в изобутилен.
Для А. характерны также р-ции, обусловленные слабокислым характером
ацетиленовой группы (рКа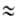 25).
При действии щелочных, щел.-зем. металлов (при нагревании, легче - в жидком
NH3) или металлоорг. соед. образуются продукты замещения водорода
в А. металлами, т. наз. ацетилениды МС 25).
При действии щелочных, щел.-зем. металлов (при нагревании, легче - в жидком
NH3) или металлоорг. соед. образуются продукты замещения водорода
в А. металлами, т. наз. ацетилениды МС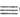 СН,
к-рые энергично реагируют с водой, регенерируя А. С магнийорг. соед. А.
легко образует магнийгалогенопроизводные А. (реактивы Иоцича). Ацетилениды
Mg, Na, Li часто используют в орг. синтезе для введения ацетиленовой группы.
Так, при взаимод. с алкилирующими агентами образуются алкилацетилены (напр.,
метилацетилен, 1-бутин, 1-пентин): RX + МС СН,
к-рые энергично реагируют с водой, регенерируя А. С магнийорг. соед. А.
легко образует магнийгалогенопроизводные А. (реактивы Иоцича). Ацетилениды
Mg, Na, Li часто используют в орг. синтезе для введения ацетиленовой группы.
Так, при взаимод. с алкилирующими агентами образуются алкилацетилены (напр.,
метилацетилен, 1-бутин, 1-пентин): RX + МС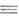 СН
-> RC СН
-> RC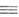 СН + MX.
Дизамещенные ацетилениды Сu2С2 и Ag2C2
образуются при действии на А. аммиачных р-ров соотв. солей Cu(I) и Ag;
эти ацетилениды взрывоопасны, напр. Сu2С2 взрывается
около 120°С. Образование Сu2С2 красного цвета часто
используют для определения А. См. также Ацетиленовые комплексы переходных
металлов. СН + MX.
Дизамещенные ацетилениды Сu2С2 и Ag2C2
образуются при действии на А. аммиачных р-ров соотв. солей Cu(I) и Ag;
эти ацетилениды взрывоопасны, напр. Сu2С2 взрывается
около 120°С. Образование Сu2С2 красного цвета часто
используют для определения А. См. также Ацетиленовые комплексы переходных
металлов.
При сжигании А. выделяется большое кол-во тепла. На этом основана ацетилено-кислородная
сварка черных металлов (на сварку расходуется около 30% производимого А.).
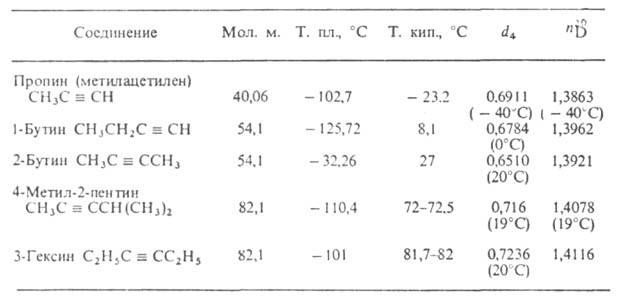
А.-родоначальник ряда ацетиленовых углеводородов (см. табл.), хим. св-ва
к-рых также определяются наличием тройной связи С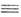 С.
Методы получения А. в пром-сти: С.
Методы получения А. в пром-сти:
1. Разложение карбида кальция водой:
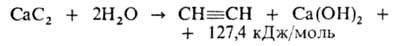
Поскольку р-ция экзотермична, необходим строгий контроль за т-рой, т.
к. при перегреве А. легко разлагается, что может привести к взрыву. Используют
генераторы производительностью до 2000 м3/ч. Примеси (NH3,
PH3, AsH3, сульфиды и др.) удаляют окислением водными
р-рами NaCIO, FcCl3 или Н2СrO4.
2. Электрокрекинг прир. газа (метана с примесью гомологов) в электродуговых
печах:
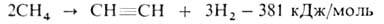
Метан пропускают между металлич. электродами при нормальном давлении,
т-ре 1600°С, времени контакта доли секунды; смесь образовавшихся газов
резко охлаждают водой. Полученный газ содержит 12-15% по объему А. (теоретически
возможно 25%), к-рый выделяют р-рением в воде под давлением. Из 1000 м3
прир. газа получают 300 кг А., 26 кг этилена, 21 кг сажи и 1170 м3
Н2. Расход электроэнергии ок. 9 кВт-ч на 1 кг неочищенного А.
3. Термоокислит. крекинг (частичное окисление) прир. газа благодаря теплу,
выделяющемуся при частичном сгорании метана (СН4:О2
= 1 :0,65):
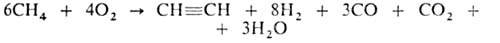
4. Пиролиз прир. газа. Над огнеупорной насадкой пропускают смесь газа
с воздухом, к-рая, сгорая, нагревает насадку до ~ 1500°С, а затем на насадке
происходит пиролиз газа-метана, разбавленного обратным газом (после выделения
А.) и водяным паром в соотношении 1:2:6. Операции повторяют многократно.
СВОЙСТВА АЦЕТИЛЕНОВЫХ УГЛЕВОДОРОДОВ
В газах, полученных методами 3 и 4, содержание А. редко достигает 20%.
Выделить его из сложной смеси продуктов довольно трудно; чаще всего используют
растворение в ДМФА или др. селективных р-рителях. Экономич. затраты на
произ-во А. термоокислит. крекингом и пиролизом вполне сравнимы с затратами
по карбидному методу. Кроме того, эти методы выгодно отличаются от карбидного
отсутствием прямого расхода электроэнергии и использованием в кач-ве сырья
прир. газа. Производств. мощности по А. в промышленно развитых странах
составляют сотни тысяч т/год.
А. взрывается при т-ре ок. 500°С или давлении выше 0,2 МПа; КПВ 2,3-80,7%,
т. самовоспл. 335°С Взрывоопасность уменьшается при разбавлении А. др.
газами, напр. N2, метаном или пропаном. А. обладает слабым токсин,
действием; ПДК 0,3 мг/м3. Хранят и перевозят его в заполненных
инертной пористой массой (напр., древесным углем) стальных баллонах белого
цвета (с красной надписью "А") в виде раствора в ацетоне под давл. 1,5-2,5
МПа. А. открыт Э.Дэви в 1836. Впервые синтезирован в 1862 М. Бертло из
угля и Н2.
===
Исп. литература для статьи «АЦЕТИЛЕН»: Ньюлэнд Ю.А., Фогт P.P., Химия ацетилена, пер. с англ.,
М., 1947; Федоренко Н. П.. Методы получения ацетилена. М.. 1958; Кононов
Н. Ф.. Островский С. А.. Устынюк Л.А.. Новая технология некоторых синтезов
на основе ацетилена, М., 1977; Котляревский И. Л., Карпицкая Л.Г., Химия
ацетилена. Томск. 1981; Kirk-Othmer encyclopedia. 3 ed., v. 1, N. Y., 1978,
p. 192-243; The chemistry of the carbon-carbon triple bond, ed. by S. Patai.
N.Y.. 1978. И.Л.Кнунянц.
Страница «АЦЕТИЛЕН» подготовлена по материалам химической энциклопедии.
|

