|
СООТВЕТСТВЕННЫХ
СОСТОЯНИЙ ЗАКОН, эмпирич. закономерность, связывающая между собой параметры
состояния в-ва-т-ру Т, давление p и уд. объем V, отнесенные
к их значениям в критич. состоянии Ткр, ркр,
Vкр. Величины т = Т/Tкр, p
= р/ркр и f = V/Vкp
называют приведенной т-рой, приведенным давлением и приведенным объемом
соотв. (приведенные параметры, или приведенные переменные). С. с. з. утверждает,
что если для группы в-в совпадают две из трех приведенных переменных, то совпадает
и третья переменная. Два в-ва считаются находящимися в соответственных состояниях,
если для них т, p и f
одинаковы.
Через приведенные параметры
м. б. записаны термич. ур-ния состояния. Так, ур-ние Ван-дер-Ваальса:
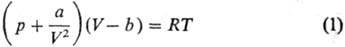
(а и b-эмпирич.
параметры, R-газовая постоянная) с помощью ур-ний (9р/9V)Ткр=0,
(92р/9V2)Ткр
= 0, характеризующих
критич. точку (см. Критическое состояние), можно привести к виду:
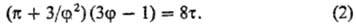
Приведенное ур-ние (2)
не содержит параметров а и b, изменяющихся от в-ва к в-ву. Оно
справедливо для всех 'в-в, подчиняющихся ур-нию состояния (1), и является для
них математич. выражением С. с. з.
В-ва, подчиняющиеся одному
и тому же приведенному ур-нию состояния, наз. термодинамически подобными. Подобие
в-в обеспечивается подобием сил межмолекулярного взаимодействия. Если
для группы подобных в-в неприведенное ур-ние состояния содержит два эмпирич.
параметра, то модельный потенциал имеет вид:
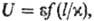
где l-расстояние
между частицами, e-глубина потенц. ямы на кривой взаимод., x-характерное
расстояние, при к-ром U = 0. Напр., потенциал Леннард-Джонса в приведенной
форме:
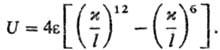
Предложена обобщающая мат.
формулировка С. с. з. в виде ур-ния, включающего нек-рый безразмерный параметр
А как критерий термодинамич. подобия в-в:
F(p,f,т;A)
= 0.
Часто в качестве такого
параметра используют величину, обратную фактору сжимаемости Z = RTкp/pкpVкр
(см. Сжимаемость). Для подобных в-в, подчиняющихся ур-нию
состояния (2), А = Z = 8/3.
Расширенный С. с. з. указывает
на наличие для группы в-в устойчивой связи между приведенными параметрами p,
f, т и нек-рыми термодинамич. св-вами ("при одинаковых p,
f, т-одинаковое свойство"). Примерами являются утверждения типа:
"разность молярных энтальпий между двумя соответственными состояниями
для подобных веществ одинаковы", "для подобных веществ молярные
энтропии испарения в точках кипения при нормальном давлении одинаковы (правило
Трутона)". Расширение С. с. з. связано с переходом от термич. ур-ния состояния
к калорическому и справедливо только при дополнит. допущениях.
Еще более расширит. толкование
имеет С. с. з. в теории поверхностного натяжения. Р. Этвеш постулировал
(1886), что поверхностная энергия, отнесенная к т-ре, для подобных в-в в соответственных
состояниях одинакова. Эмпирич. ур-ние Этвеша для поверхностного натяжения о:
sV3/2/T=2,22(1/т-1).
С. с. з. сформулирован
в кон. 19 в. и в настоящее время ни в одном из вариантов не может рассматриваться
как всеобщий. Он служит в качестве основы для классификации в-в по термодинамич.
св-вам, наряду с др. формами такой классификации, и может использоваться для
прогнозирования св-в неизученных в-в.
===
Исп. литература для статьи «СООТВЕТСТВЕННЫХ СОСТОЯНИЙ ЗАКОН»: Ландау Л.
Д., Лифшиц Е. М., Статистическая флика, 3 изд., ч. 1, М., 1976; Филиппов Л.
П., Подобие свойств веществ, М., 1978. М. В. Коробов.
Страница «СООТВЕТСТВЕННЫХ СОСТОЯНИЙ ЗАКОН» подготовлена по материалам химической энциклопедии.
|

