|
СУЛЬФАМИНОВАЯ КИСЛОТА
(моноамид серной к-ты, амидосерная к-та) NH2SO2OH, мол.
м. 97,098; бесцв. кристаллы ромбич. сингонии, а - 0,8036 нм, b =
0,8025 нм, с = 0,9236 нм, z = 8; т. пл. 205 °С; плотн. 2,126
г/см3 (25 °С); 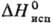 1147,6 кДж/кг,
1147,6 кДж/кг, 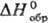 -685,9 кДж/моль; К 1,006 (вода,
25 °С); рН 1н. р-ра 0,41 (25 °С). Р-римость в воде (г в 100 г): 12,80
(0°С), 17,57 (20 °С), 22,77 (40 СС), 27,06 (60 °С), 32,01
(80 °С). Р-римость в орг. р-рителях при 25 °С (% по массе): в формамиде-0,18,
метаноле-0,4, ацетоне-0,04, диэтиловом эфире-0,01.
-685,9 кДж/моль; К 1,006 (вода,
25 °С); рН 1н. р-ра 0,41 (25 °С). Р-римость в воде (г в 100 г): 12,80
(0°С), 17,57 (20 °С), 22,77 (40 СС), 27,06 (60 °С), 32,01
(80 °С). Р-римость в орг. р-рителях при 25 °С (% по массе): в формамиде-0,18,
метаноле-0,4, ацетоне-0,04, диэтиловом эфире-0,01.
В кристаллич. состоянии
С. к, образует цвиттер-ион 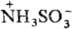 . При нагр. до 260 °С разлагается на SO2, SO3, N2
и Н2О. При комнатной т-ре С. к. практически не подвергается
гидролизу, при повыш. т-рах гидролизуется до (NH4)2SO4
(в кислой среде скорость гидролиза увеличивается). С металлами, их оксидами,
гидроксидами и карбонатами С. к. образует соли NH2SO3M
(сульфаматы), с тионилхлоридом-сульфамоилхлорид NH2SO2C1;
при взаимодействии с HNO2 подвергается окислит, дезамини-рованию:
NH2SO3H + HNO2 : Н2О + N2
+ H2SO4. Последнюю р-цию используют для количеств. определения
С. к. и для разложения избытка HNO2 в производстве азокрасителей.
. При нагр. до 260 °С разлагается на SO2, SO3, N2
и Н2О. При комнатной т-ре С. к. практически не подвергается
гидролизу, при повыш. т-рах гидролизуется до (NH4)2SO4
(в кислой среде скорость гидролиза увеличивается). С металлами, их оксидами,
гидроксидами и карбонатами С. к. образует соли NH2SO3M
(сульфаматы), с тионилхлоридом-сульфамоилхлорид NH2SO2C1;
при взаимодействии с HNO2 подвергается окислит, дезамини-рованию:
NH2SO3H + HNO2 : Н2О + N2
+ H2SO4. Последнюю р-цию используют для количеств. определения
С. к. и для разложения избытка HNO2 в производстве азокрасителей.
Хлор, бром, хлораты и КМnО4
окисляют С. к. до H2SO4 и N2; р-ция с НС1О
или NaClO приводит к N-хлор- или N,N-дихлорпроизводным; р-ция с Na
в жидком NH3-к NaSO3NHNa, а с Na2SO4-K
аддукту 6HSO3NH2·5Na2SO4·15Н2О.
С. к. реагирует с фенолами,
первичными и вторичными спиртами, напр.: С6Н5ОН + NH2SO3H
: C6H5OSO3NH4 : :
HOC6H4SO2ONH4. Первичные, вторичные
и третичные амины образуют с С. к. аминосульфаматы RNH2·HOSO2NH2
(ариламиносульфаматы, как правило, неустойчивы), амиды карбоновых к-т-N-ацилсульфаматы
аммония, напр.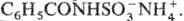
В пром-сти С. к. получают
взаимод. мочевины с SO3 и H2SO4: NH2CONH2
+ SO3 + H2SO4 : 2NH2SO3H
+ CO2. С. к. может быть получена также; взаимод. мочевины с ClSO2OH,
SO2 с NH2OH или SO3 с NH3 в безводной
среде и др.
Для идентификации С. к.
используют р-цию с HNO2, сплавление с бензоином и др.
С. к. применяют для очистки
пром. аппаратов и оборудования (входит в состав антинакипинов), для введения
групп SO3H и NHSO3H в орг. соед., в качестве стандартного
в-ва в ацидиметрии, для определения нитрит-ионов. Суль-фамат аммония NH2SO3NH4
применяют для придания огнезащитных св-в текстильным материалам, сульфамат никеля
(NH2SO3)2Ni-KaK компонент электролитов для
никелирования, N-хлорпроизводные С.к.-в качестве дезинфицирующих ср-в. Соли
циклогексилсульфаминовой к-ты C6H11NHSO3M (цикламаты,
напр. М = Na, К) производились в США как малокалорийные заменители сахара, однако
из-за канцерогенных св-в их производство запрещено.
С. к. вызывает ожоги кожных
покровов и слизистых оболочек. ЛД50 1600 мг/кг (крысы), 3100 мг/кг
(мыши). Обладает значительно меньшей коррозионной активностью, чем соляная и
серная к-ты.
===
Исп. литература для статьи «СУЛЬФАМИНОВАЯ КИСЛОТА»: Andrieth L.,
Andersen К., "Chem. Rev.", 1940, v. 26, p. 49; Kirk-Othmer
encyclopedia, 3 ed., v. 21, N.Y., 1983, p. 949; Gmelin, v. 9, p. 1582.
H.A. Тилькунова.
Страница «СУЛЬФАМИНОВАЯ КИСЛОТА» подготовлена по материалам химической энциклопедии.
|

