|
СУЛЬФИНОВЫЕ КИСЛОТЫ,
соед. общей ф-лы RS(O)OH, где R-opг. остаток. Алифатические С.к.-малоустойчивые
жидкости, ароматические-твердые в-ва. В кристаллич. состоянии и в неполярных
р-рителях имеют димерную структуру:
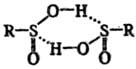
Ароматические С. к. более
устойчивы, чем алифатические. Наиб. стабильностью обладают соли или водные р-ры,
а также С. к., содержащие в молекуле электроноакцепторные или объемистые группы.
Молекулы С. к. имеют форму тетраэдра с хиральным атомом S в вершине.
С. к. называют, добавляя
к назв. соединения-основы окончание "сульфиновая к-та", напр. 2-бутансульфиновая
к-та. Если в соед. присутствует др. группа, имеющая приоритет, к назв. соединения-основы
добавляют префикс "сульфино", напр. 4,6-дисульфино-1-нафтойная к-та.
В ИК спектрах С. к. присутствуют
характеристик, полосы в области 1130-1150 см , соответствующие валентным колебаниям
связи S—О. В УФ спектрах lмакс. 240-245 нм (п :
p*-переход своб. пары электронов атома S).
По кислотности С. к. занимают
промежут. положение между соответствующими сульфокислотами и карбоновыми к-тами.
С. к. обладают всеми характерными
св-вами к-т: образуют эфиры RS(O)OR' и соли (сульфинаты), галогенангидриды RS(O)Hal
(сульфинилгалогениды), сульфинамиды RS(O)NR'2 и др. В водных р-рах
С. к. полностью диссоциированы. При стоянии или нагревании диспропорционируют
на суль-фокислоты и S-эфиры тиосульфокислот: 3RS(O)OH : : RSO2OH
+ RSO2SR + Н2О.
Под действием окислителей
(Н2О2, HNO3, I2, гипохло-риты, КМnО4
и др.) С. к. образуют сульфокислоты RSO2OH. Восстановление приводит,
в зависимости от условий р-ции, к тиолам, дисульфидам или S-эфирам тиосульфокислот:
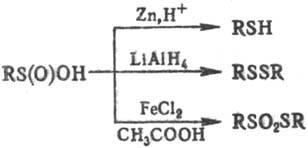
С. к. вступают в разл.
хим. р-ции в качестве нуклеофилов с реакц. центром на атоме S; сульфинат-акионы,
генерируемые из С. к. в щелочной среде, проявляют амбидентные св-ва. В присут.
оснований С. к. реагируют с алкил- и арилгалогенидами с образованием сульфоноз,
более "жесткие" алкилирующие агенты (напр., тетрафтороборат три-этилоксония)
дают продукты О-алкилирования:
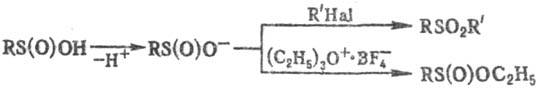
Присоединение С. к. по
кратным связям алкенов, алленов, ацетиленов приводит к соответствующим сульфонам;
взаи-мод. с альдегидами-к a-гидроксисульфонам, с эпоксидами в присут. оснований-к
b-гидроксисульфонам, напр.:
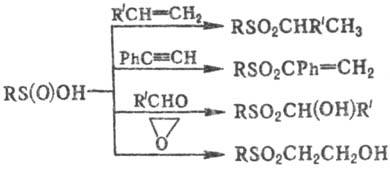
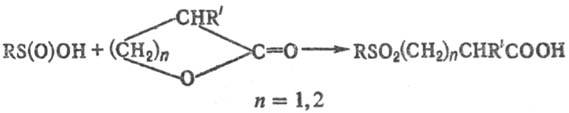
С. к. раскрывают циклы
b- или g-лактонов с образованием b- или g-сульфонилкарбоновых
к-т, напр,:
Ароматические С. к. легко
реагируют с сульфенилгало-генидами, образуя S-эфиры тиосульфокислот ArSO2SR.
Получают С. к. восстановлением
производных сульфокис-лот, чаще всего сульфонилгалогенидов. В качестве восстановителей
используют порошок Zn в нейтральной или основной среде, Fe, Na-Hg, Mg, Ca, Al,
SnCl2 и др., а также анионные нуклеофилы, напр. сульфиты, сульфиды,
тиолаты, гидриды и т.д., напр.:
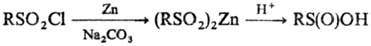
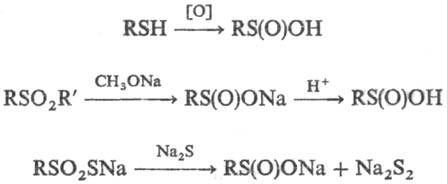
С. к. образуются при окислении
тиолов или дисульфидов галогенами, разб. Н2О2, м-С1С6Н4СОООН
и др., при расщеплении сульфонов алкоголятами щелочных металлов или щелочами
либо S-эфиров тиосульфокислот кислыми или щелочными агентами, напр.:
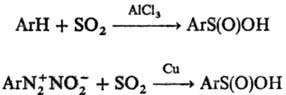
Ароматические С. к. получают
также сульфинированием ароматич. углеводородов в условиях р-ции Фриделя-Крафт-са
или разложением диазониевых солей в присут. SO2 и Сu:
Удобный метод получения
труднодоступных Ск.-суль-финирование металлоорг. соединений SO2:
C6H5MgBr
+ SO2 : C6H5SO2MgBr :
C6H5S(O)OH +
Mg(OH)Br
С.к.-интермедиаты разл.
биохим. процессов в организме животных; так, при окислении цистеина образуются
цис-теинсульфиновая к-та NH2CH(CH2SO2H)COOH
и 2-ами-ноэтансульфиновая к-та (гипотаурин); последняя выделена из отдельных
видов моллюсков.
Применяют С. к. и их производные
в качестве катализаторов низкотемпературной полимеризации, флотац. агентов,
эмульгаторов, регуляторов роста растений, промежут. продуктов в синтезе лек.
препаратов.
С. к. и ее соли раздражают
кожные покровы и верх, дыхат. пути.
===
Исп. литература для статьи «СУЛЬФИНОВЫЕ КИСЛОТЫ»: Общая органическая
химия, пер. с англ., т. 5, М., 1983, с. 491-96; Ullmanns Encyklopadie,
4 Aufl., Bd 22, Weinheim, 1982, S. 315-21.
И.И.Крылов.
Страница «СУЛЬФИНОВЫЕ КИСЛОТЫ» подготовлена по материалам химической энциклопедии.
|

