|
СУЛЬФОКСИДЫ, соед.
общей ф-лы RR'SO (R и R'-алкил, арил, аралкил и др.). Назв.
ациклических С. производят от назв. двух орг. радикалов, связанных с атомом
S, с прибавлением слова "сульфоксид"; назв. циклических С. производят
от назв. соответствующего гетероцикла с окончанием "оксид", напр.
тииран-1-оксид, или тиацшшопропан-1-оксид.
В природе С. найдены в
нек-рых растениях. Так, S-аллил-L-цистеинсульфоксид CH2=CHCH2S(O)CH2CH(NH2)COOH
(аллиин)-в чесноке, сульфофарен CH3S(O)CH=CHCH2NCS-в семенах
редиса, изотиоцианаты, содержащие группу SO, ф-лы CH3S(O)(CH2)nNCS
(n = 3-11)-в растениях семейства крестоцветных.
Структура молекулы С. -
искаженная пирамида. Для ди-метилсульфоксида (ДМСО) длины связей 0,147 нм (S—О),
0,182 нм (S—С), 0,108 нм (С—Н), углы OSC 107°, CSC 100°. Константы Гаммета
для группы CH3SO sпара 0,51, sмета
0,48.
Несимметричные С. могут
существовать в виде энантио-меров. Известны термич., фотохим. рацемизация и
рацемизация под действием хим. реагентов, гл. обр. электро-филов.
В ИК спектрах С. присутствуют
характеристич. полосы в области 1050-1060 см-1, соответствующие валентным
колебаниям группы SO.
С.-бесцв. малолетучие жидкие
или кристаллич. в-ва (см. табл.), хорошо раств. в большинстве орг. р-рителей;
ДМСО и тетраметиленсульфоксид смешиваются с водой во всех отношениях.
СВОЙСТВА НЕКОТОРЫХ
СУЛЬФОКСИДОВ
|
| |
|
|
|
| Диметилсульфоксид
(CH3)2SO |
78,13
|
18,4 |
85-87/20
|
| Диэтилсульфоксид
(C2H5)2SO |
106,19 |
14
|
104/25 |
| Дибутилсульфоксид
(C4H9)2SO |
162,30 |
32,6 |
- |
Дифенилсульфоксид
(C6H5)2SO
|
|
|
|
С.-очень слабые основания,
с сильными к-тами (НС1, HBr, HNO3) образуют соли типа R2SO
· НС1; под действием разл. реагентов, напр. Н2О2, окисляются
до сульфонов RR'SO2; под действием восстановителей (LiAlH4,
NaBH4, H2 в присут. Pd, дихлорборан, трихлорсилан, Ph3P
и др.) образуют сульфиды RR'S.
Подобно карбонильным соед.,
конденсация С. с производными аминов и амидов приводит к сульфимидам RR'S=NR:
(R''-алкил, арил, ацил), а при одновременном окислении-к сульфоксимидам RR'S(O)=NR:.
Нуклеоф. св-ва С. проявляются
в легкости образования алкокси- и гидроксисульфониевых солей, что используется,
напр., для окисления бензил- и аллилгалогенидов или тозилатов:
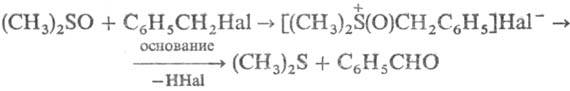
Под действием ангидридов
карбоновых к-т С. превращ. в a-ацилтиоэфиры (перегруппировка Пуммерера);
в случае несимметричных С. ацилоксигруппа присоединяется к наим. замещенному
атому С., напр.:
(CH3)2CHS(O)CH3
+ (CH3CO)2O : (CH3)2CHSCH2OCOCH3
С. подвергаются перегруппировке
также под действием хлорангидридов карбоновых к-т, изоцианатов, неорг. галогенидов
(SiCl4, PC13, SO2C12 и др.), напр.:
CH3S(O)CH3
+ С6Н5СОС1 : CH3SCH2Cl + С6Н5СООН
При термолизе или в присут.
сильных оснований С. способны элиминировать сульфеновые к-ты, напр.:
PhCH(CH3)CH(Ph)S(O)Ph
: PhC(CH3)=CHPh + [PhSOH]
Действие гидридов или алкоголятов
металлов на С. приводит к реакционноспособным a-сульфинилкарбанионам типа
RS(O)CH2; действие реагентов, генерирующих положительно
заряженный галоген (NOCl, РhIСl2, Сl2, Вr2 и
др.),-к a-галогенсодержащим С.
Получают С. окислением
сульфидов (окислители: оксиды азота, р-ры Н2О2, м-хлорнадбензойная
к-та, гипохлориты и др.); используют также р-ции сульфинатов и С. с ме-таллоорг.
соединениями, перегруппировку эфиров сульфено-вых к-т, присоединение монооксида
S к полиенам.
Наиб. значение имеют диметилсульфоксид
и нефтяные С., получаемые окислением серосодержащих компонентов нефти. Нефтяные
С.-экстрагенты редких металлов, флотореа-генты цветных металлов.
===
Исп. литература для статьи «СУЛЬФОКСИДЫ»: Общая органическая
химия, пер. с англ., т. 5, М., 1983, с. 253-318. А.Ф.Елеев.
Страница «СУЛЬФОКСИДЫ» подготовлена по материалам химической энциклопедии.
|

