|
ТВЕРДОФАЗНЫЙ СИНТЕЗ,
методич. подход к синтезу олиго(поли)меров с использованием твердого нерастворимого
носителя (Н.), представляющего собой орг. или неорг. полимер. Т.е. основан на
том, что первое звено будущего олигомера ковалентно закрепляется на "якорной"
группе Н., наращивание цепи проводится стандартно защищенными мономерами по
обычным схемам, используемым для синтеза в р-рах. На заключит. этапе синтезир.
олигомер отщепляется от Н. и очищается соответствующими методами. Т. с. применяют
в осн. для получения полипептидов, олиго-нуклеотидов и олигосахаридов.
При синтезе полипептидов
в качестве Н. наиб. широко используют сополимер стирола и 1-2% дивинилбензола,
модифицированный введением диметоксибензилхлоридной якорной группы для присоединения
первой аминокислоты (с защищенной группой NH2) по С-концу,
напр.:
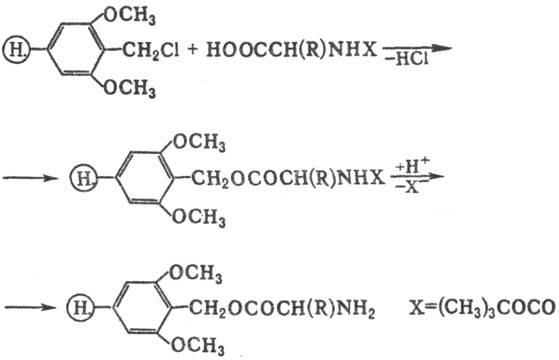
После удаления N-защитной
группы наращивание полипептидной цепи проводят стандартными методами пептидного
синтеза в р-ре (см. Пептиды). В качестве конденсирующих агентов наиб.
часто используют карбодиимиды или предварительно превращают аминокислоты в активир.
эфиры.
При синтезе олигонуклеотидов
в качестве Н. используют макропористые стекла или силикагель. Якорной группой
служит карбоксильная группа, отделенная от пов-сти Н. спец. "ножкой",
напр.:
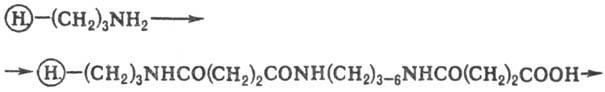
В-пуриновое или пиримидиковое
основание
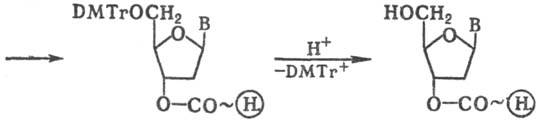
На первой стадии нуклеозид
присоединяют к носителю по 3'-гидроксильной группе дезоксирибозы, у к-рой гидрок-сильная
группа в положении 5' защищена диметокситри-тильной группой (СН3ОС6Н4)2
(С6Н5)С (DMTr); кол-во последней после ее отщепления легко
измеряется спектро-фотометрически, что служит количеств. характеристикой загрузки
носителя и позволяет оценить выходы на последующих стадиях наращивания олигонуклеотидной
цепи. После удаления группы DMTr сборку цепи осуществляют с помощью фосфитамидов
(ф-ла I; M. Kapoзерс, 1980) или фосфонатов (гидрофосфонатов) (II; Р. Стремберг,
1986):
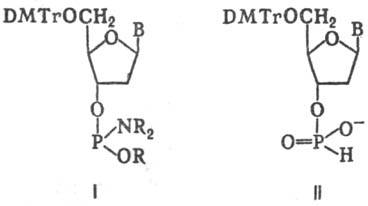
Для осуществления Т. с.
необходимы высокие выходы (на уровне 96-99%) на каждой стадии р-ции, а также
эффективные методы очистки и выделения синтезир. соединений.
Использование твердой фазы
позволяет существенно упростить и ускорить проведение каждой стадии наращивания
цепи олигомера, поскольку отделение избытка компонентов, конденсирующих агентов
и побочных продуктов, находящихся в р-ре, достигается фильтрованием реакц. смеси
и отмывкой Н. подходящим набором р-рите-лей. Т. обр., процесс сборки цепи олигомера
распадается на ряд стандартных операций: деблокирование растущего конца цепи,
дозирование очередного защищенного мономера и конденсирующего агента, подача
этой смеси на колонку с Н. в течение рассчитанного времени и отмывка Н. подходящим
р-рителем. Цикл наращивания мономерного звена м. б. автоматизирован.
В основе автоматич. пром.
синтезаторов лежит общая принципиальная схема (см. рис.). Многочисл. модели
синтезаторов различаются конструкцией колонок и их кол-вом, способом подачи
реагентов и р-рителей и др. Управление и программирование осуществляют с помощью
встроенного или вынесенного компьютера.
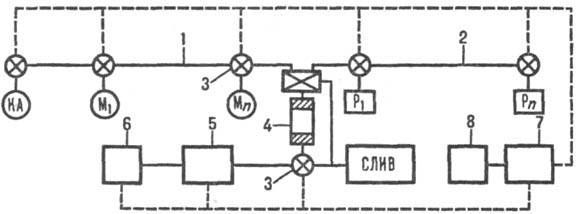
Принципиальная схема устройства
автоматич. пром. синтезаторов (электрич. линия управления обозначена пунктиром):
1 -линия подачи мономеров (М1, Мn) и конденсирующего
агента (КА); 2-линия подачи реагентов (напр., окислителей, ацилирующих агентов,
к-т и др.) и р-рителей (P1, Рn); 3 - переключающие
клапаны; 4-колонка с носителем, снабженная распределит. клапаном; 5-фотометрич.
ячейка; 6-измеритель; 7-блок управления и программирования; 8-дисплей.
Потенциальные возможности
Т.е. были продемонстрированы синтезом рибонуклеазы А (Р. Меррифилд, 1969) и
гормона роста человека (Д. Ямаширо, 1970) длиной 124 и 183 аминокислоты соответственно.
Однако в связи с небольшой,
но постоянной рацемизацией, происходящей при образовании пептидной связи, синтезир.
белки обладают низкой биол. активностью, поэтому автоматич. синтезаторы используются
гл. обр. для получения коротких полипептидов (10-30 звеньев), в т. ч. для препаративного
синтеза белка (1г).
Т.е. предложен и введен
в практику Меррифилдом (1962) для синтеза полипептидов, а затем распространен
на синтез олигонуклеотидов (Р. Летзингер, 1964) и олигосахаридов (А. Патчорник,
1973).
Существует др. важный аспект
использования Н. для проведения мн. орг. р-ций (ацилирование, галогенирование,
конденсация и т. д.). В этом случае модифицир. Н. выступает в роли полимерного
реагента или катализатора, а все превращения субстрата происходят в р-ре. Напр.,
р-цию фосфатов ROP(O)(OH)2 со спиртами проводят с использованием
в качестве конденсирующего агента сшитого полистирола, модифицированного сульфохлоридной
группой.
===
Исп. литература для статьи «ТВЕРДОФАЗНЫЙ СИНТЕЗ»: Химия полипептидов,
пер. с англ., М., 1977; Polyner-supported reactions in organic synthesis, ed.
by P. Hodge, D.C. Sherrington, Chichester, 1980; Oligonucleotide synthesis,
A practical approach. Wash., 1984. B.K. Потапов.
Страница «ТВЕРДОФАЗНЫЙ СИНТЕЗ» подготовлена по материалам химической энциклопедии.
|

