|
ТЕЛЛУР (от лат.
tellus, род. падеж telluris-Земля; лат. Tellurium) Те, хим. элемент VI гр. периодич.
системы, относится к халькогенам, ат. н. 52, ат. м. 127,60. Природный
Т. состоит из восьми изотопов: 120Те (0,089%), 122Те (2,46%),
123Те (0,89%), 124Те (4,74%), 125Те (7,03%),
126Те (18,72%), 128Те (31,75%) и 130Те (34,27%).
Конфигурация внеш. электронной оболочки 5s2 5p4;
степени окисления — 2, + 4, +6, редко +2; энергия ионизации при последоват.
переходе от Те0 к Те6+ 9,010, 18,6, 28,0, 37,42, 58,8,
72,0 эВ; сродство к электрону ~ 2 эВ; электроотрицательность по Полингу 2,10;
атомный радиус 0,17 нм, ионные радиусы, нм (в скобках указаны координац. числа):
Те2 0,207(6), Те4+ 0,066(3), 0,80(4), 0,111(6), Те6+
0,057(4), 0,070(6).
Содержание в земной коре
1 · 10 % по массе. Известно ок. 100 минералов Т., в т.ч. самородный Т., алтаит
РbТе, гессит Ag2Te, силъванит AuAgTe4, калаверит АuТе2,
тетра-димит Bi2Te2S. Т. входит в качестве изоморфной примеси
в сульфидные минералы-халькопирит, галенит, пирит, пентландит и др. Т. извлекают
в осн. из медных, свинцовых, пиритных руд, где он находится как в рассеянном
состоянии, так и в виде микровкрапленностей собств. минералов. Известны золото-теллуровые
месторождения с собственно теллуровой минерализацией, не имеющие существенного
значения.
Свойства. Т.-серебристо-серое
в-во с металлич. блеском, в тонких слоях на просвет-красно-коричневого цвета,
в парах-золотисто-желтый. Кристаллизуется в гексагон. решетке, а = 0,44566
нм, с = 0,59268 нм, z = 3, пространств. группа P3121;
структура состоит из параллельно расположенных спиральных цепочек; плотн.
6,247 г/см3. Т. наз. аморфный Т. с плотн. ~ 5,9 г/см3,
получаемый осаждением из r-ров, представляет собой микродисперсный кристаллический
Т. При давлении ~ 4,2 ГПа при 25 °С образуется модификация TeII со структурой
типа b-Sn, а при ~6,3 ГПа-ТеIII с ромбоэдрич. структурой; обе модификации
имеют металлич. св-ва. Т. пл. 449,8 °С, т. кип. 990 °С; 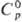 25,8 Дж/(моль · К);
25,8 Дж/(моль · К); 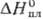 17,5 кДж/моль,
17,5 кДж/моль, 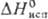 51,0 кДж/моль;
51,0 кДж/моль; 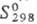 49,46 ДжДмоль · К); теплопроводность
1,8 Вт/(м·К)· температурный коэф. линейного расширения 0,2·10-6 К-1;
ур-ния температурной зависимости давления пара для кристаллического Т. lgp
(мм рт.ст.) = = 19,667 - 9232/T+ 2,100 lg T+ 2,308·10-3
Т (298 - 723 К), для жидкого lgp (мм рт. ст.) = 6,402 — 6016/Т
— -0,4001gT(723-_1263 K); r 3,7·109 Ом·м, температурный
коэф. r 3,79·10-3 К-1; полупроводник p-типа,
ширина запрещенной зоны 0,32 эВ. Расплав Т. выше ~ 700 °С обладает металлической
проводимостью. Т. диамагнитен, магн. восприимчивость — 0,31·10-9.
Твердость по Моосу 2,3, по Бринеллю 180-270 МПа; сопротивление разрыву 10,8
МПа. Т. хрупок, при нагревании становится пластичным.
49,46 ДжДмоль · К); теплопроводность
1,8 Вт/(м·К)· температурный коэф. линейного расширения 0,2·10-6 К-1;
ур-ния температурной зависимости давления пара для кристаллического Т. lgp
(мм рт.ст.) = = 19,667 - 9232/T+ 2,100 lg T+ 2,308·10-3
Т (298 - 723 К), для жидкого lgp (мм рт. ст.) = 6,402 — 6016/Т
— -0,4001gT(723-_1263 K); r 3,7·109 Ом·м, температурный
коэф. r 3,79·10-3 К-1; полупроводник p-типа,
ширина запрещенной зоны 0,32 эВ. Расплав Т. выше ~ 700 °С обладает металлической
проводимостью. Т. диамагнитен, магн. восприимчивость — 0,31·10-9.
Твердость по Моосу 2,3, по Бринеллю 180-270 МПа; сопротивление разрыву 10,8
МПа. Т. хрупок, при нагревании становится пластичным.
Для Т. нормальный электродный
потенциал 0,56 В. Т., даже дисперсный, устойчив на воздухе, но при нагр. горит
(пламя голубое с зеленым ореолом) с образованием ТеО2 (см. Теллура
оксиды). Кристаллический Т. реагирует с водой выше 100°С, аморфный-выше
50 °С. Конц. р-ры щелочей растворяют Т. с образованием теллуридов и
теллуритоз. Соляная к-та и разб. H2SO4 на Т. не действуют,
конц. H2SO4 растворяет его, образующиеся красные р-ры
содержат катион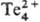 .
Разб. HNO3 окисляет Т. до теллуристой к-ты Н2ТеО3
(соли-теллуриты), концентрированная-до Те2О3 (ОН) NO3.
Сильными окислителями (HСlО3, КМnО4 и др.) окисляется
до теллуровой к-ты Н6ТеОб (соли-тел-лураты). Т. раств.
в р-рах сульфидов и полисульфидов щелочных металлов (с образованием тиотеллуридов
и тио-теллуритов), в солянокислых р-рах Fed,. Реагирует с р-рами солей Ag. В
CS2 не растворяется. С Сl2, F2 и Вr2 реагирует
при комнатной т-ре, с I2-при нагр., сплавляется с S, P (соединений
при этом не образует), As (давая As2Te3), с Si (с образованием
Si2Te3 и SiTe), с Se (образуя при кристаллизации твердые
р-ры). С бором и углеродом непосредственно не взаимод., с СО при нагр. образует
газообразный нестойкий карбонил ТеСО. При сплавлении с металлами получают теллуриды. .
Разб. HNO3 окисляет Т. до теллуристой к-ты Н2ТеО3
(соли-теллуриты), концентрированная-до Те2О3 (ОН) NO3.
Сильными окислителями (HСlО3, КМnО4 и др.) окисляется
до теллуровой к-ты Н6ТеОб (соли-тел-лураты). Т. раств.
в р-рах сульфидов и полисульфидов щелочных металлов (с образованием тиотеллуридов
и тио-теллуритов), в солянокислых р-рах Fed,. Реагирует с р-рами солей Ag. В
CS2 не растворяется. С Сl2, F2 и Вr2 реагирует
при комнатной т-ре, с I2-при нагр., сплавляется с S, P (соединений
при этом не образует), As (давая As2Te3), с Si (с образованием
Si2Te3 и SiTe), с Se (образуя при кристаллизации твердые
р-ры). С бором и углеродом непосредственно не взаимод., с СО при нагр. образует
газообразный нестойкий карбонил ТеСО. При сплавлении с металлами получают теллуриды.
Теллуроводород Н2Те-бесцв.
газ с неприятным запахом; в жидком состоянии зеленовато-желтый, кристаллический-лимонно-желтый;
т. кип. — 2°С, т. пл. — 51 °С; плотн. 5,81 г/л; для газа 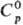 35,6 Дж/(моль · К),
35,6 Дж/(моль · К),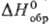 99,7 кДж/моль,
99,7 кДж/моль,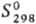 222,8
Дж/(моль · К); DHпл 4,2 кДж/моль, 222,8
Дж/(моль · К); DHпл 4,2 кДж/моль, 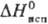 23 кДж/моль; а сухом воздухе при комнатной т-ре медленно разлагается, во влажном
окисляется до Т.; при нагревании на воздухе горит, давая ТеО2; р-римость
в воде 0,1 М, водный р-р-слабая к-та, К1 2·10-3;
сильный восстановитель; получают взаимодействием Аl2Те3
с соляной к-той, а также электролизом р-ра H2SO4 с теллуровым
катодом при 0°С; применяют для получения Т. высокой чистоты.
23 кДж/моль; а сухом воздухе при комнатной т-ре медленно разлагается, во влажном
окисляется до Т.; при нагревании на воздухе горит, давая ТеО2; р-римость
в воде 0,1 М, водный р-р-слабая к-та, К1 2·10-3;
сильный восстановитель; получают взаимодействием Аl2Те3
с соляной к-той, а также электролизом р-ра H2SO4 с теллуровым
катодом при 0°С; применяют для получения Т. высокой чистоты.
Гексафторид ТеF6-бесцв.
газ; т. пл. — 37,8°С, т. возг. -38,6°С; плотн. 10,7 г/л; для газа 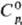 117,6 Дж/(моль·К),
117,6 Дж/(моль·К), 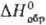 -1318 кДж/моль,
-1318 кДж/моль, 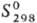 336 ДжДмоль · К);
336 ДжДмоль · К);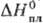 9 кДж/моль,
9 кДж/моль,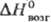 27
кДж/моль; в сухом воздухе устойчив, не
действует на стекло; в воде раств., постепенно гидролизу ясь с образованием
фторотеллуровых к-т ТеFn(ОН)6-n, где n
— от 1 до 4, и в конечном счете-теллуровой к-ты; с фторидами металлов образует
соед., напр. Ag[TeF7] и Ba[TeF8]; получают фторированием
Т. при нагревании. Тстрафторид TeF4-кристаллы ромбич. сингонии; т.
пл. 129,6°С, т.
кип. 194°С (с разл.); плотн. 4,22 г/см3; очень гигроскопичен,
легко гидролизуется; с фторидами щелочных металлов образует пентафторотеллураты
M[TeF5]; получают действием SeF4 на ТеО2. Фториды
Т.-фторирующие агенты. 27
кДж/моль; в сухом воздухе устойчив, не
действует на стекло; в воде раств., постепенно гидролизу ясь с образованием
фторотеллуровых к-т ТеFn(ОН)6-n, где n
— от 1 до 4, и в конечном счете-теллуровой к-ты; с фторидами металлов образует
соед., напр. Ag[TeF7] и Ba[TeF8]; получают фторированием
Т. при нагревании. Тстрафторид TeF4-кристаллы ромбич. сингонии; т.
пл. 129,6°С, т.
кип. 194°С (с разл.); плотн. 4,22 г/см3; очень гигроскопичен,
легко гидролизуется; с фторидами щелочных металлов образует пентафторотеллураты
M[TeF5]; получают действием SeF4 на ТеО2. Фториды
Т.-фторирующие агенты.
Тетрахлорид ТеС14-желтые
кристаллы; т. пл. 224°С, т. кип. 381,8°С; плотн. 3,01 г/см3;
ур-ние температурной зависимости давления пара gp (мм рт. ст.) = 8,791
— - 3941/T (497 - 653 К); 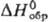 -323,8 кДж/моль,
-323,8 кДж/моль,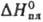 18,9 кДж/молъ,
18,9 кДж/молъ,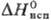 71,1
кДж/моль; очень гигроскопичен, водой
гидролизуется; в конц. НС1 раств., образуя хлоротел-луровую к-ту Н2ТеС16;
из солянокислых р-ров экстрагируется трибутилфосфатом и др. орг. р-рителями;
с хлоридами щелочных металлов образует гекса- М2[ТеСl6]
и пентахлортел-лураты М[ТеС15], с хлоридами Al, Fe(III), Zr
и др.-комплексы с катионами 71,1
кДж/моль; очень гигроскопичен, водой
гидролизуется; в конц. НС1 раств., образуя хлоротел-луровую к-ту Н2ТеС16;
из солянокислых р-ров экстрагируется трибутилфосфатом и др. орг. р-рителями;
с хлоридами щелочных металлов образует гекса- М2[ТеСl6]
и пентахлортел-лураты М[ТеС15], с хлоридами Al, Fe(III), Zr
и др.-комплексы с катионами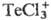 ,
напр. ТеС13 [GaCl4]; получают хлорированием Т.; ТеСl4-исходное
в-во для получения Т. высокой чистоты. Коричневый дихлорид ТеС12
устойчив в парах и м. б. сконденсирован в жидкость. Получены также два кристаллич.
низших хлорида-серебристо-серый Те2Сl3 и метастабильный
черный с металлич. блеском Те2Сl. ,
напр. ТеС13 [GaCl4]; получают хлорированием Т.; ТеСl4-исходное
в-во для получения Т. высокой чистоты. Коричневый дихлорид ТеС12
устойчив в парах и м. б. сконденсирован в жидкость. Получены также два кристаллич.
низших хлорида-серебристо-серый Те2Сl3 и метастабильный
черный с металлич. блеском Те2Сl.
Осаждением из водных р-ров
можно получить сульфиды TeS2 и TeS3, разлагающиеся при
нагр.; известны TeS7 и Te7S10. Тиотеллураты
(напр., Na2TeS3) м.б. получены растворением Т. в р-ре
полисульфидов щелочных металлов или S-в р-рах полителлуридов, а также сплавлением.
Тиотеллураты-промежут. продукты в нек-рых процессах извлечения Т. См. также
Теллурорганические соединения.
Получение. Осн.
источники Т.-шламы электролитич. рафинирования Сu и шламы сернокислотного произ-ва,
а также щелочные дроссы рафинирования Pb . При переработке сернокислотных шламов
методом обжига (см. Селен)Т. остается в огарке, к-рый выщелачивают соляной
к-той. Из солянокислого р-ра пропусканием SO2 осаждают Se, после
чего р-р разбавляют до содержания к-ты 10-12% и при нагр. действием SO2
осаждают Т.
При спекании шламов с содой
и послед. выщелачивании Т. переходит в р-р и при нейтрализации осаждается в
виде ТеО2. Т. получают либо прямым восстановлением ТеО2 углем,
либо осаждением при действии SO2 на солянокислые р-ры ТеО2.
При переработке шламов сульфидным методом (выщелачивание р-ром Na2S)
Т. выделяют из р-ра (после осаждения Se аэрацией) действием сухого Na2S2O3:
Na2TeS3
+ 2Na2SO3 : Те + 2Na2S2O3
+ Na2S
При переработке медеэлектролитных
шламов Т. в осн. переходит в содовые шлаки, получающиеся при переплавке остатков
на золото-серебряный сплав ("металл Дорэ"). При использовании сульфатизации
часть Т. переходит в сульфатные р-ры вместе с Си. Из них Т. осаждают действием
металлич. Си:
Н2ТеО3
+ 4H2SO4 + 6Сu : Те + Си2Те + 4CuSO4
+ 6Н2О
Из содовых шлаков Т. извлекают
после растворения в воде либо нейтрализацией с осаждением ТеО2 (его
очищают переосаждением из сульфидных или кислых р-ров, растворяют в щелочи и
выделяют Т. электролизом), либо прямо из содового р-ра электролизом осаждают
черновой Т. Его восстанавливают А1 в щелочном р-ре:
6Те + 2А1 + SNaOH :
3Na2Te2 + 2NaAlO2 + 4Н2О Затем Т.
осаждают аэрацией:
2Na2Te2
+ 2Н2О + О2 : 4Те + 4NaOH
Для очистки Т. используют
переосаждение из кислых, щелочных или теллуридных р-ров. Дополнит. очистка достигается
при переплавке порошкообразного Т. с добавкой NaNO3 и др. реагентов.
Для получения Т. высокой чистоты используют его летучие соед., в частности ТеСl4,
к-рый очищают дистилляцией или ректификацией и экстракцией из солянокислого
р-ра. После гидролиза хлорида ТеО2 восстанавливают Н2.
Иногда для очистки используют также Н2Те. На завершающих стадиях
очистки применяют вакуумную сублимацию, дистилляцию или ректификацию Т., а также
зонную плавку или направленную кристаллизацию.
Определение. Большинство
методов качеств. обнаружения Т. основано на окислит.-восстановит. р-циях. При
использовании щелочных р-ров станнита, фосфорноватистой к-ты и др. восстановителей
получают черный или коричневый осадок, в р-циях с солями Си и персульфатом Na-красно-коричневый
комплекс Cu(II). Из орг. реагентов применяют антразо, к-рый в солянокислой среде
с соединениями Т. дает сине-зеленый осадок.
Количественно Т. определяют
гравиметрически (с осаждением либо элементарного Т. при действии восстановителей,
либо ТеО2), титриметрически (чаще других используют тиосульфатный
и иодометрич. методы), фотометрич. и флуорометрич. методами (основаны на образовании
комплексов с серосодержащими орг. реагентами -висмутолом II, диэтилдитиокарбаматом,
тиомочевиной и их производными, а также с орг. основаниями -производными пиразо-лона
и родаминовыми красителями). Используют полярог-рафич. и атомно-адсорбционный
методы.
Применение. Важнейшая
область применения Т.—синтез разл. теллуридов, обладающих полупроводниковыми
св-вами. Т. используют также в металлургии для легирования чугуна и стали, Рb,
Сu (для повышения их мех. и хим. стойкости). Т. и его соед. применяют в произ-ве
катализаторов, спец. стекол, инсектицидов, гербицидов и т.п.
Мировое произ-во Т. (без
СССР) ок. 220 т/год (1985). Осн. производители-Япония, США и Канада.
Т. в 1782 выделил И. Мюллер,
в 1789-П. Китабейль, в 1798 Т. выделил и идентифицировал М. Клапрот.
Т. и в особенности его
соед. токсичны. Т. вызывает тошноту, бронхиты, пневмонию и пневмосклероз, нарушения
нуклеинового и белкового обмена и др. ПДК Т. в воздухе 0,01 мг/м3,
в воде 0,01 мг/л.
===
Исп. литература для статьи «ТЕЛЛУР»: Чижиков Д.
М., Счастливый В. П., Теллур и теллуриды, М., 1966; Сошникова Л. А., Купченко
М. М., Переработка медеэлектро-литных шламов, М., 1978. См. также лит. при ст.
Селен. П. И. Федоров.
Страница «ТЕЛЛУР» подготовлена по материалам химической энциклопедии.
|

