|
ТЕРМОДИНАМИКА
ИЕРАРХИЧЕСКИХ СИСТЕМ, изучает сложные гетерог. хим. и биол. системы,
прежде всего открытые системы, обменивающиеся со средой в-вом и энергией.
В зависимости от целей и задач исследования протекающие в этих системах процессы
могут рассматри-заться как неравновесные или как равновесные (квазиравновесные),
а состояние системы-как нестационарное или как стационарное (квазистационарное).
Подход Т. и. с. состоит в
представлении подобной системы в виде совокупности соподчиненных подсистем,
иерархически связанных расположением в пространстве (структурная или пространств.
иерархия) и(или) временами установления равновесия при релаксации (временная
иерархия).
В каждый момент времени
система (или одна из подсистем) м. б. охарактеризована средними удельными (по
объему или по массе) ф-циями состояния, стремящимися к экстремуму при достижении
равновесия (обладающими экстремальными св-вами). Изменение состояния системы
(подсистемы) во времени (эволюция системы) исследуется по изменениям этих ф-ций.
Используется гл. обр. ф-ция Гиббса (энергия Гиббса) G*(p, Т, Хi),
где p -давление, Т-т-ра, Xi-обобщенная сила (любой
интенсивный параметр состояния, за исключением давления); для сложной системы
G* = U + pV— Xixi — TS, где U- внутр.
энергия, V- объем, хi - обобщенная координата (любой
экстенсивный параметр состояния, за исключением объема), S-энтропия;
величины p, T и Xi являются естественными независимыми
переменными ф-ции G*. Для открытой системы полный дифференциал dG*
записывается в виде:
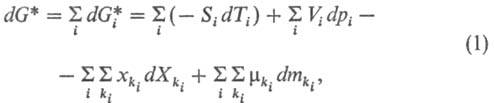
где индекс i обозначает
протекающий в системе процесс взаимод. между компонентами (хим. взаимод., межмолекулярное,
взаимод. надмолекулярных структур и т.п.), ki-компонент, участвующий
в этом процессе,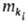 -его
масса, -его
масса, 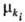 -т. наз. эволюционный потенциал, в широком смысле-движущая сила процесса (см.
ниже).
-т. наз. эволюционный потенциал, в широком смысле-движущая сила процесса (см.
ниже).
Т. обр., Т. и. с. распространяет
подход Гиббса на сложные открытые гетерог. системы и позволяет практически в
той же степени опираться на методы вариац. исчисления, что и классич. термодинамика;
в принципе у открытых систем не существует термодинамич. ф-ций состояния, характеризующихся
экстремальными св-вами. Для описания эволюции иерархич. систем и их подсистем
используют методы макрокинетики.
Примером прир. иерархич.
системы является биол. популяция pop (сообщество организмов), в к-рой
можно выделить след. подсистемы: организмы org, клетки cel,
надмолекулярные образования or, макромолекулы mm, молекулы m
и т. д. Все эти подсистемы соподчиненно (иерархически) расположены в пространстве
и обладают иерархией времен релаксации ti (характерных времен
жизни), а именно эти времена, связанные сильными неравенствами и расположенные
в порядке возрастания (или убывания), образуют иерархич. ряд:
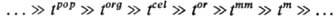
Осн. понятие Т. и. с.-частная
эволюция [г'-й процесс в ф-ле (1)], т.е. агрегация ki-х компонентов
системы, участвующих в i-м процессе, на j-м уровне иерархии. В
случае закрытой (простой) физ.-хим. системы агрегация структурных элементов-неравновесный
самопроизвольный процесс, для к-рого убыль ф-ции Гиббса можно определить согласно
второму началу термодинамики. Так, неравновесную кристаллизацию жидкости ниже
т-ры плавления можно рассматривать как агрегацию зародышей кристаллизации (верх.
иерархич. уровень) в объеме однородной жидкости (ниж. иерархич. уровень). Убыль
ф-ции Гиббса системы можно вычислить по приближенному ур-нию Гиббса-Гельмгольца
DG = DH(DТ/Тпл), где DH-изменение
энтальпии системы при кристаллизации, DT= Тпл
— Т> 0 (Тпл-т-ра плавления в-ва, Т-т-ра кристаллизации
переохлажденного в-ва). Аналогично можно вычислить убыль ф-ции Гиббса для процессов
агрегации структурных элементов при спирализации цепей ДНК, агрегации молекул
белков или полисахаридов с образованием надмолекулярных структур, агрегации
надмолекулярных образований, клеток и т.д. Сопоставляя, напр., изменения ф-ции
Гиббса процессов образования разл. надмолекулярных структур DGim,
можно судить о термодинамич. стабильности этих структур.
Установлено, что в ходе
эволюции живых прир. систем на каждом иерархич. уровне повышается термодинамич.
стабильность структурных элементов, составляющих данный уровень. Согласно принципу
структурной стабилизации, i-й процесс, протекающий на 7-м структурном
уровне, стабилизирует продукты (i-1)-го процесса предыдущего (j —
1)-го (более низкого) иерархич. уровня. Поскольку система является открытой,
агрегация j-х структурных элементов накапливает наиб. стабильные (j
+ 1)-е структуры на данном иерархич. уровне. Напр., в нек-рых прир. системах
накапливаются в-ва с повышенной (по абс. величине) ф-цией Гиббса DGim
образования определенных надмолекулярных структур (этот эффект в нек-ром смысле
аналогичен накоплению в хроматографич. колонке в-ва с повыш. энергией Гиббса
адсорбции DGa вследствие того, что время удерживания
этого в-ва tret зависит от DGim экспоненциально):
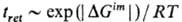
(R-газовая постоянная).
В Т. и. с. вводится представление
об эволюц. потенциале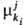 компонента
ki, участвующего в i-м процессе на j-м
иерархич. уровне. В общем случае компонента
ki, участвующего в i-м процессе на j-м
иерархич. уровне. В общем случае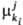 представляет
собой изменение соответствующего термодинамич. потенциала при бесконечно малом
изменении числа элементов ki-гo типа в частной эволюции (i-й
процесс на j-м уровне). Так, представляет
собой изменение соответствующего термодинамич. потенциала при бесконечно малом
изменении числа элементов ki-гo типа в частной эволюции (i-й
процесс на j-м уровне). Так,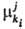 может
быть определен через G*: может
быть определен через G*:
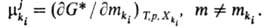
В этом смысле хим. потенциал
компонента системы является частным случаем эволюц. потенциала. Эволюц. потенциал
позволяет наиб. простым и универсальным способом определять условия равновесия
внутри любой подсистемы. Т. и. с. определяет направленность эволюц. процесса
как процесса структурообразования (самосборки; см. Самоорганизация).
Показано, что эволюция прир. систем обусловлена стремлением к экстремальным
значениям уд. величин термодинамич. ф-ций (ф-ции Гиббса, ф-ции Гельмгольца и
т. п.). Напр., при образовании надмолекулярной структуры на 7-м иерархич. уровне
вследствие межмолекулярного взаимод. усредненная по объему ф-ция Гиббса биол.
системы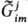 стремится
к минимуму. В этом случае стремится
к минимуму. В этом случае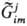 является
интегральной величиной, характеризующей нестационарную открытую гетерог. систему: является
интегральной величиной, характеризующей нестационарную открытую гетерог. систему:
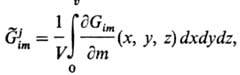
где V- объем системы,
т-масса, х, у, z-координаты. В результате взаимод. (агрегации) j-х
надмолекулярных образований появляется новая структурно выделенная подсистема,
обладающая большим характерным временем жизни, т.е. (j + 1)-й уровень
иерархии. Вследствие обмена каждой из подсистем со средой система в целом накапливает
наиб. стабильные структуры, т. е. структуры, обладающие повыш. ф-цией Гиббса
образования (агрегации). Эти структуры преим. аккумулируют хим. соединение с
повыш. ф-цией Гиббса образования (повыш. энергоемкостью). Т. обр., в процессе
эволюции биол. система обогащается липидами, белками, полисахаридами и т. п.
и обедняется водой, что проявляется в изменении ее брутто-состава. Вариации
хим. состава живых организмов в онтогенезе и филогенезе имеют термодинамич.
природу.
Т. и. с. позволяет анализировать
поведение физ.-хим., эко-логич. систем, передачу биол. признаков по наследству.
Основы Т. и. с. сформулированы
в 80-х гг. 20 в.
===
Исп. литература для статьи «ТЕРМОДИНАМИКА ИЕРАРХИЧЕСКИХ СИСТЕМ»: Гладышев Г.
П., Термодинамика и макрокинетика природных иерархических процессов, М., 1988;
Васнецова А. Л., Гладышев Г. П., Экологическая
биофизическая химия, М., 1989; Gladyshev G. P., "Journal of Biological
Systems", 1993, v. 1, № 2. G. П. Гладышев.
Страница «ТЕРМОДИНАМИКА ИЕРАРХИЧЕСКИХ СИСТЕМ» подготовлена по материалам химической энциклопедии.
|

