|
ТИОКАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ,
орг. соед., содержащие тиокарбонильную группу В статье рассмотрены тиоальдегиды
RCH=S и 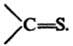 тиокетоны
RR'C=S. О других Т.е. см. Дитиокарбоновые кислоты, Тиокарбоновые кислоты,
Тиоугольные кислоты. тиокетоны
RR'C=S. О других Т.е. см. Дитиокарбоновые кислоты, Тиокарбоновые кислоты,
Тиоугольные кислоты.
Тиоальдегиды и тиокетоны
называют аналогично соответствующим альдегидам и жетонам, используя суффиксы
"тиаль" (или "карботиальдегид") и "тион",
напр.: CH3CH2CH2CHS называют бутантиаль; в
полифункцион. соединениях используют префиксы "тиоформил" и "тиоксо"
(или "тионо"), напр.: SСНС6Н4СООН называют
тиофор-милбензойная к-та, CH3C(S)CH2CH2C6H4COOH
называют (3-тиоксобутил)бензойная к-та, назв. нек-рых Т.е. производят от назв.
их кислородных аналогов с префиксом "тио", напр, тиоформальдегид
HCHS, тиоацетон CH3C(S)CH3.
Алифатические Т.е. в виде
мономеров существуют только в газовой фазе при низком давлении (время жизни
от неск. минут до неск. недель); при нормальных условиях образуют бесцв. циклодимеры
(1,3-дитиетаны), циклотримеры (1,3,5-тритианы)
и линейные полимерыдля многих из
к-рых возможна термич. деполимеризация.
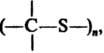
Алифатические Т.е. окрашены
в цвета от желтого до темно-синего и обладают чесночным запахом. b-Функциональные
a,b-не-насыщ. ароматические и гетероциклические Т.е. имеют более глубокую
окраску, слабый "овощной" запах; как правило, термодинамически устойчивы.
В Т.е. длина связи C=S
ок. 0,16 нм, ее полярность ниже, а поляризуемость выше, чем у связи С=О. В ИК
спектрах Т.е. присутствуют неск. полос поглощения в области 950-1270 см-1.
Электронные спектры содержат, как правило, три области поглощения в интервалах
500-700, 250-300 и 210-240 нм, соответствующие n:p*-, p:p*-
и n:s*-переходам. В спектрах ПМР хим. сдвиг (d) 9-13
м.д. (CH=S) и находится в более слабом поле, чем у соответствующих альдегидов.
Для мн. пар Т.е. и их кислородных аналогов установлена корреляция между хим.
сдвигами в спектрах ЯМР 13С: d(C=S) = 1,46d(С=O) - 49,4
(м.д.).
Строение Т.е. может быть
представлено резонансом структур, что обусловливает их хим. св-ва:

Т.е. легко присоединяют
по тиокарбонильной группе ну-клеофилы: воду, спирты, амины и др., образуя чаще
всего гем-бифункцион. аддукты; при возможности дальнейшего отщепления
H2S образуются те же продукты (имины и их замещенные,
азометины и др.), что и из соответствующих карбонильных соед., напр.:
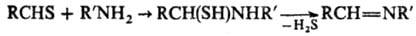
Металлоорг. нуклеофилы
присоединяются к алифатическим Т.е. как по атому С, так и по атому S, а к ароматическим
Т.е. и перфтортиоацетону, как правило, только по атому S, напр.:
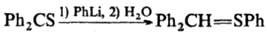
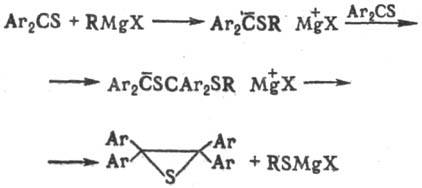
Взаимод. диарилтиокетонов
с избытком реактива Гринья-ра приводит к тииранам, напр.:
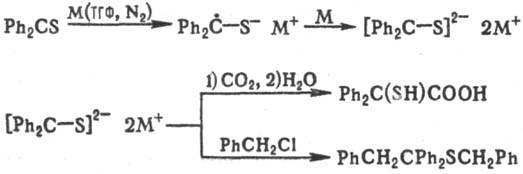
Ароматические Т.е., будучи
сильными акцепторами электронов, образуют со щелочными металлами последовательно
малоактивный анион-радикальный и далее дианионный комплекс, имеющий важное препаративное
значение, напр.:
Р-ции с электрофилами особенно
характерны для Т.е., способных образовывать ентиольную таутомерную форму, напр.:
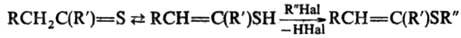
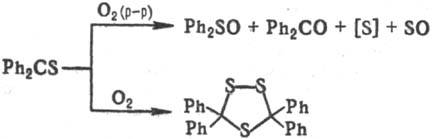
Окисление Т.е. О2
в зависимости от условий протекает по разным направлениям:
Восстановление Т.е. приводит
к тиолам и(или) углеводородам.
Большинство Т.е. вступает
в диеновый синтез в качестве диенофилов; с диазосоед. образуют, в зависимости
от природы реагентов, тиираны или 1,3-дитиоланы.
Специфич. р-ция Т.е. (в
отличие от карбонильных соед.) - образование олефинов при натр. в присут. металлов
(Zn, Cu, Fe):
2Ar2CS + 2Zn
: Аr2С=САr2 + 2ZnS
Общие методы синтеза Т.е.
1) Тионирование карбонильных
соед. и их азааналогов под действием разл. осерняющих реагентов: H2S,
P4S10, CS2, S2Cl2, S8,
(R2NS)2, RCOSH, Na2S2O3,
а также соед. ф-лы I
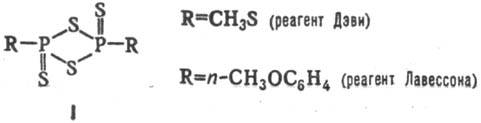
Р-цию проводят в тщательно
подобранных условиях во избежание побочных р-ций (восстановления, гетероциклиза-ции,
глубокого осернения).
2) Р-ции енаминов, эфиров,
енолов, алкенилгалогенидов с H2S, NaSH, Na2S, Na2S2O3.
3) Взаимод. алкил- или
аралкилхлоридов и гем-дигало-генидов с S-нуклеофилами, напр.:
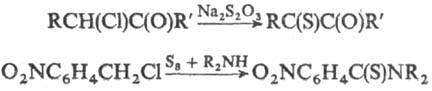
Для получения ароматических
и гетероциклических Т.е. используют NaSH, CH3COSH, тиомочевину, SiS2
и др.
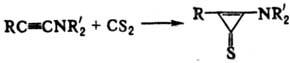
4) Присоединение H2S,
CS2 и др. к ацетиленам, напр.:
5) Термолиз гем-дитиолов,
сульфидов, S-гетероциклов, напр.: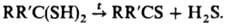
6) Фотохим. превращения
серосодержащих соед.:
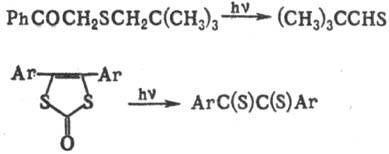
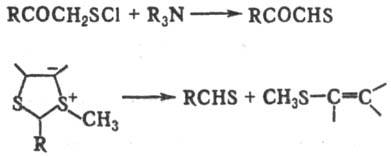
Для получения тиоальдегидов
используют также нуклеоф. расщепление сульфенилхлоридов, сульфениламидов, тио-цианатов,
сульфидов, дисульфидов, солей Бунте (S-алкил-тиосульфатов) либо расщепление
мезоионных 1,3-дитиола-нов:
Тиокетоны м.б. получены
из кетонов в условиях конденсации Клайзена:
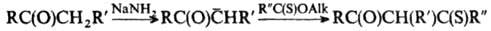
Ароматич. тиокетоны получают
окислением Аr2СН2, Аr2С=САr2, Ar2CHNH2
и Ph2C=PPh3 элементной серой при 140-270 °С; тиоацшшрованием
ароматич. соединений в условиях р-ции Фриделя-Крафтса, напр.:
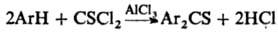
Т.е. применяют в качестве
интермедиатов в тонком орг. синтезе. Среди Т.е. найдены бактерициды и др. биологически
активные препараты.
===
Исп. литература для статьи «ТИОКАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ»: Общая органическая
химия, пер. с англ., т. 5, М., 1983; Usov V.A., Voronkov М. G., "Sulfur
reports", 1982, v. 2, № 2, p. 39-85. В. А. Усов.
Страница «ТИОКАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ» подготовлена по материалам химической энциклопедии.
|

