|
ТИОСУЛЬФАТЫ НЕОРГАНИЧЕСКИЕ
(устар.-гипосульфиты), соли тиосерной к-ты H2S2O3.
Тиосерная (серноватистая) к-та неустойчива даже при 77 К, в водных р-рах разлагается
с образованием SO2 и S.
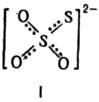
Тиосульфаты (Т.)-кристаллы,
содержат анион ф-лы I неправильной тетраэдрич. формы, длина связи S—О 0,148
нм, S—S 0,199 нм. Р-римость Т. в воде (г в 100 г): K2S2O3
200,1 (35 °С), 233,4 (56 °С); (NH4)2S2O3
150 (20 °С); MgS2O3 49,8 (20 °С); CaS2O3
42,9 (10 °С); SrS2O3 15,3 (10 °С); BaS2O3
0,2 (0°С); Tl2S2O3 0,18 (25 °С); PbS2O3
0,02 (18 °С). Т. образуют кристаллогидраты, наиб. важны: К2S2О3-5Н2О,
т. пл. 35,0 °С; К2S2О3·3Н2О,
т. пл. 56,1 °С; K2S2О3·H2О,
т. пл. 78,3 °С, плотн. 2,590 г/см3; MgS2O3·6H2O,
т. пл. вьппе 82 °С, плотн. 1,818 г/см3, 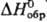 -5283 кДж/моль; CaS2O3·6H2O,
т. пл. вьппе 40 °С, плотн. 1,872 г/см3,
-5283 кДж/моль; CaS2O3·6H2O,
т. пл. вьппе 40 °С, плотн. 1,872 г/см3,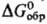 — 3982 кДж/моль.
— 3982 кДж/моль.
Безводные Т. при натр.
не плавятся, в инертной атмосфере разлагаются до сульфатов и полисульфидов,
напр.: К2S2О3 (плотн. 2.23 г/см3)
разлагается при ~430°С, PbS2O3 (плотн. 5,18г/см3)-при
~250°С, (КН4)2S2О3-при ~150°С.
При нагревании Т. на воздухе параллельно происходит окисление. Наличие серы
в степени окисления —2 в Т. определяет восстановит. св-ва иона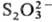 .
Так, Na2S2O3 окисляется I2
с образованием тетратионата Na2S4O6 (р-ция
лежит в основе иодометрии), K2S2O3, Na2S2O3
и др. окисляются Сl2 или Вr2 с образованием S и сульфатов.
К2S2О3 окисляется SO2, SCl2
с образованием политионатов. Нек-рые Т. образуют р-римые в воде комплексные
соед., напр. Na3[Ag(S2O3)2], что
позволяет растворять нек-рые осадки солей Ag, напр. AgBr (р-ция лежит в основе
закрепления в фотографии). .
Так, Na2S2O3 окисляется I2
с образованием тетратионата Na2S4O6 (р-ция
лежит в основе иодометрии), K2S2O3, Na2S2O3
и др. окисляются Сl2 или Вr2 с образованием S и сульфатов.
К2S2О3 окисляется SO2, SCl2
с образованием политионатов. Нек-рые Т. образуют р-римые в воде комплексные
соед., напр. Na3[Ag(S2O3)2], что
позволяет растворять нек-рые осадки солей Ag, напр. AgBr (р-ция лежит в основе
закрепления в фотографии).
Получают Т. окислением
при нагр. на воздухе полисульфидов К, Na, Са, Ва, р-цией M2SO3
с S, M2S2 с MHSO3 (М-К, Na и др.), взаимод.
SO2 и H2S с КОН (NaOH). Малорастворимые тиосульфаты Ва,
Тl, Рb осаждают действием Na2S2O3 на р-ры их
солей. Нек-рые Т. получают обменными р-циями сульфатов с BaS2O3.
Наиб. применение имеет
натрия тиосульфат. CaS2O3 в смеси с полисульфидами
Са-фунгицид (известково-сер-ный отвар), ср-во для удаления волос в кожев. пром-сти.
K2S2O3 используют для получения "серной
печени" (см. Калия сульфиды), политионатов. MgS2O3-6H2O-лeк.
ср-во при нек-рых сердечно-сосудистых заболеваниях и вегетативных расстройствах.
И. Н. Один. ТИОСУЛЬФАТЫ ОРГАНИЧЕСКИЕ, соли и эфиры орга-нилтиосерных
к-т общей ф-лы RSSO2X, где R-Alk, Аr; Х-ОМ (М-металл), OR'.
Названия Т. о. образуются
из названия орг. радикала и суффикса "тиосульфат" с указанием атома,
с к-рым связан орг. радикал, напр. СН3SSО2ОС2Н5-S-металэтилтиосуль-фат,
С6Н5SSО2ОКа-S-фенилтиосульфат натрия.
Наио. практич. значение
имеют S-алкил- и S-арилтио-сульфаты щелочных металлов (соли Бунте)-твердые кри-сталлич.
в-ва, хорошо раств. в воде.
Хим. св-ва Т.о. обусловлены
легкостью расщепления связи S—S под действием нуклеоф. и электроф. реагентов.
Гидролиз Т.о., катализируемый к-тами,-удобный препаративный метод синтеза тиолов,
при щелочном гидролизе образуются диалкилдисульфиды, напр.:
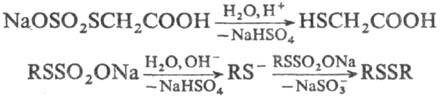
Р-ция Т.о. с тиолатами-метод
синтеза несимметричных дисульфидов, напр.:
CH3SSO2ONa
+ NaSC6H5 : CH3SSC6H5
+ Na2SO3
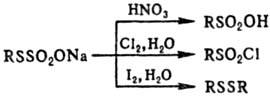
При окислении Т.о. в зависимости
от окислителя м.б. получены алкансульфокислоты, алкансульфонилгалогениды или
диалкилдисульфиды, напр.:
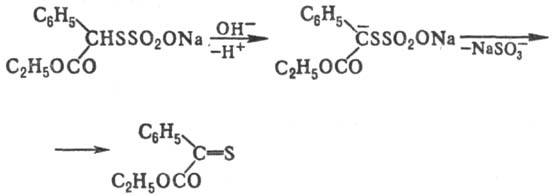
Нек-рые Т.о., содержащие
в орг. радикале a-H-атом, под действием оснований образуют тиокарбонильные
соед., напр.:
Общий метод получения солей
Бунте-взаимод. алкил-галогенидов, диалкилсульфатов или алкиларилсульфонатов
с тиосульфатами щелочных металлов в эквимолярном соотношении в водно-орг. среде
(напр., в 50%-ном водном этаноле):
AlkX + Na2S2O3
: AlkSSO2ONa + NaX X = Hal, OSO2OAlk, OSO2Ar
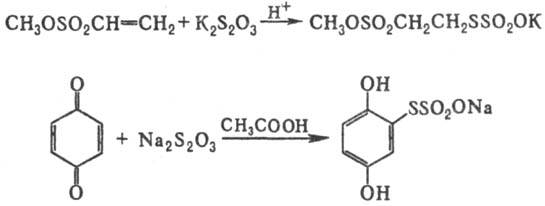
Соли Бунте получают также
присоединением тиосуль-фатов щелочных металлов к активир. алкенам или хинонам
в присут. к-т, напр.:
Соли Бунте, как правило,
не выделяют, а используют без очистки для дальнейших превращений.
Арилтиосульфаты получают
р-циями диарилдисульфидов с гидросульфитом калия:
2ArSSAr + 6КНSО3
: 4ArSSO2OK + K2S2O3 + 3Н2О
Алкил(арил)тиосерные к-ты
получают при взаимод. тиолов с SО3 или его комплексами с орг. основаниями,
либо с хлорсульфоновой к-той, напр.:
СН3SН + SО3
: СН3SSО2ОН С6Н5SН + SO3
· C5H5N : C6H5SSO2OH
· C5H5N
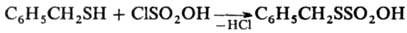
Применяют Т.о. в осн. в
орг. синтезе в качестве полупродуктов для получения орг. соед. серы.
===
Исп. литература для статьи «ТИОСУЛЬФАТЫ НЕОРГАНИЧЕСКИЕ»: Джильберт
Э. Э., Сульфирование органических соединений, пер. с англ., М., 1969. А.
Ф. Ермолов.
Страница «ТИОСУЛЬФАТЫ НЕОРГАНИЧЕСКИЕ» подготовлена по материалам химической энциклопедии.
|

