|
ТИОЦИАНАТЫ ОРГАНИЧЕСКИЕ
(орг. роданиды), эфи-ры тиоциановой к-ты общей ф-лы RSCN. Наиб. значение имеют
алкил- и арилтиоцианаты. Алкилтиоцианаты-бесцв. жидкости со слабым запахом лука-порея,
арилтиоцианаты -высококипящие жидкости или твердые в-ва; не раств. в воде, раств.
в орг. р-рителях.
В ИК спектрах Т.о. присутствует
характеристич. полоса в области 2130-2160 см-1 (колебания группы
C=N).
Окисляются Т.о. HNO3
до сульфокислот, хлором в воде-до сульфохлоридов, надкислотами-до сульфоцианидов:
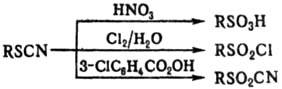
Восстановление Т.о. LiAlH4,
Na2S, Na в жидком NH3, NaBH4, Zn в к-те приводит
к тиолам.
Щелочи превращают Т.о.
в дисульфиды: RSCN + ОН- : : RS- + HOCN; RSCN
+ RS- : RSSR + CN-.
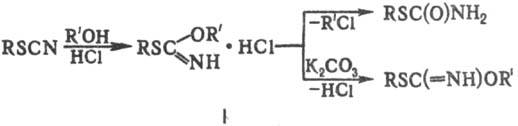
При взаимодействии Т.о.
со спиртами в присут. НС1 образуются хорошо кристаллизующиеся гидрохлориды эфи-ров
иминотиоугольных к-т (ф-ла I), к-рые м.б. использованы для идентификации Т.о.
При стоянии соед. I превращ. в тиокарбаматы либо (при обработке поташом)-в соответствующие
эфиры:
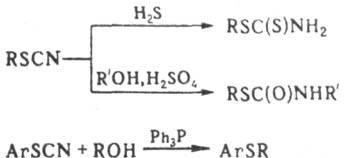
Р-ция Т.о. с H2S
приводит к S-зфирам дитиокарбаминовой к-ты, со спиртами в присут. к-т - к S-эфирам
тиокарбамино-вой к-ты, арилтиоцианаты со спиртами в присут. Ph3P
дают сульфиды:
При нагр. (часто при перегонке)
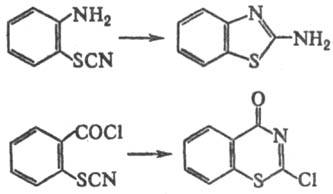
Т.о. изомеризуются в изотиоцианаты (см. ниже). Т.о.
легко циклизуются по атому С или N тиоцианатной группы:
Наиб. общий метод синтеза
алкил- и арилтиоцианатов -обработка орг. галогенидов, сульфатов или сульфонатов
тиоцианатами щелочных металлов (выходы >70%); продукт часто бывает загрязнен
изотиоцианатами, особенно в тех случаях, когда р-ция протекает по механизму
SN1: RX + -SCN : RSCN + X-.
Р-цию можно проводить в условиях межфазного катализа. Неактивир. арилгалогени-ды
не вступают в р-ции нуклеоф. замещения. Удобный метод синтеза арилтиоцианатов-замена
диазогруппы в условиях р-ции Зандмейера: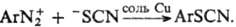
Т.о. образуются при взаимод.
диазокетонов с роданид-анионом в кислых водных р-рах; при обработке соед. ф-лы
RSX (X = Cl, SCN, SO3M, SR или фталимидогруппа) цианидами; при действии
на тиолы галогенцианов или цианидов и Вr2 в СН3ОН, насыщенном
NaBr, напр.:
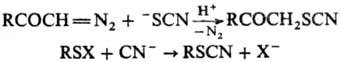
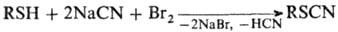
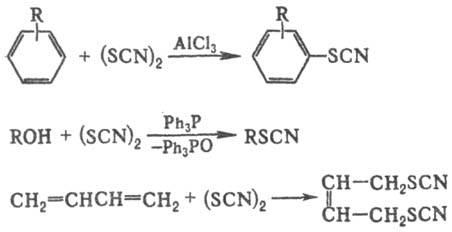
Т.о. получают также исходя
из родана (тиоциана): вза-имод. последнего с ароматич. соединением в присут.
к-т Льюиса приводит к арилтиоцианатам, со спиртами в присут. Рb3Р-к
алкилтиоцианатам (при этом вторичные спирты частично, а третичные нацело превращ.
в изотиоциана-ты), присоединение к непредельным соед.-к дитиоциано-производным
(в случае сопряженных диенов преобладает 1,4-присоединение), напр.:
Т.о. используют в качестве
инсектицидов и протравителей семян, а также как стабилизаторы хлорир. углеводородов,
смазок, эмульгаторов.
Метилтиоцианат и этилтиоцианат
высокотоксичны, ла-криматоры. Большинство Т.о. практически нетоксичны.
Изотиоцианаты (И., изороданиды,
горчичные масла)-соед. общей ф-лы RN=C=S. Низшие И.-стабильные бесцв. жидкости
с характерным запахом; ацилизотиоциана-ты-менее стабильны, с резким неприятным
запахом.
В ИК спектрах И. присутствует
сильная, широкая, часто расщепленная характеристич. полоса в области 2100-2000
см-1 (валентные колебания группы NCS); в УФ спектрах алифатических
И.-полоса поглощения в области 244-248 нм (e ! 103), ароматические
И. поглощают при более высоких длинах волн.
И. легко присоединяют соед.,
содержащие подвижный атом Н:
RNCS + НХ : RNHQS)X
X = OR', OAr, SH, SR, CN,
NH2, NHR, NRR', NHNH2, SO3Na и др.
При р-циях с карбоновыми
и тиолкарбоновыми к-тами образуют амиды (одновременно выделяются COS или CS2);
при взаимод. с карбанионами, полученными из соед. с активными метильными или
метиленовыми группами, а также с реактивами Гриньяра-тиоамиды, напр.:
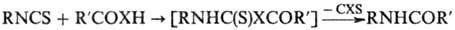
Х = O, S RNCS + -СН(СООСН3)2
: RNHC(S)CH(COOCH3)2
ArNCS + RMgl : ArNHC(S)R
И. восстанавливаются Zn
в НСl до RNH2, LiАlН4-до RNHCH3, NaВН4-до
RNHC(S)H, при действии HgO образуются соответствующие изоцианаты.
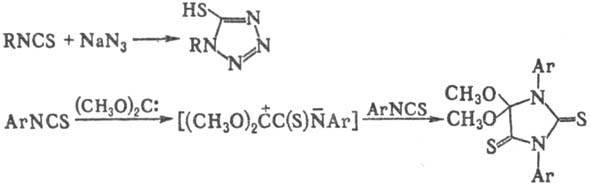
И.-полупродукты в синтезе
гетероциклич. соединений. Так, при взаимод. с NaN3 образуются меркаптотетразолы;
р-ция арилизотиоцианатов с диметоксикарбеном приводит к 5,5-диметоксидитиогидантоинам:
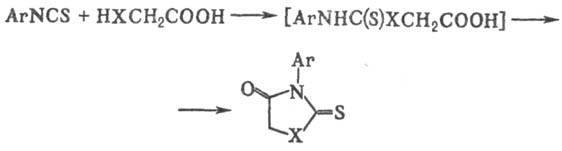
В р-циях И. с нуклеоф.
реагентами (в случае, если одно или оба реагирующих в-ва содержат дополнит.
функц. группу) гетероциклич. соединения часто образуются самопроизвольно, напр.
при взаимод. арилизотиоцианатов с а-меркап-то- или a-аминокислотами:
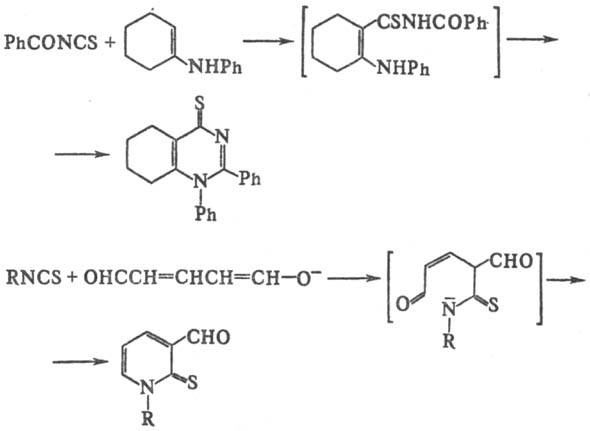
И. могут использоваться
для получения шестичленных гетероциклич. соед., напр. при взаимод. с енаминами
или при р-ции с анионом глутаконового диальдегида:
Р-ция с ароматич. углеводородами
в условиях р-ции Фриделя - Крафтса приводит к вторичным ароматич. тио-амидам.
В нек-рых случаях возможно внутримол. тиокар-бамоилирование, напр.:
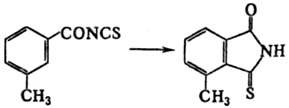
Осн. методы получения И.-термич.
перегруппировка тиоцианатов (используют гл. обр. для синтеза ацилизо-тиоцианатов)
и обработка первичных аминов тиофос-геном:
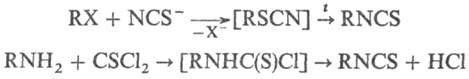
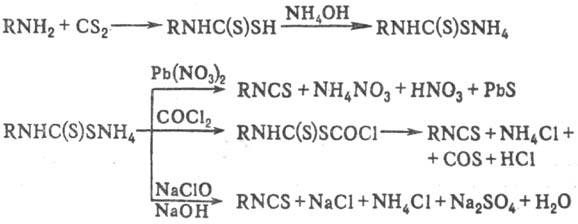
И. получают также разложением
разл. производных дитиокарбаминовой к-ты, напр. солей (последние образуются
при взаимод. первичных аминов с CS2 в присут. оснований):
Алифатические и ароматические
И. легко образуются при обработке CS2 первичными аминами в присут.
дициклогек-силкарбодиимида либо при обработке N,N'-дизамещенных тиомочевин
Р2О5 или сильными конц. к-тами при повыш. т-рах.
И. могут быть получены
из N,N'-тиокарбонилдиимидазо-ла: аминолиз последнего дает соответствующую
тиомоче-вину, к-рая подвергается термич. разложению:
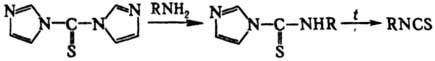
И. используют для модифицирования
смол, применяемых в произ-ве синтетич. волокон; для получения полиизотио-цианатов.
Нек-рые И. обладают бактерицидными, фунги-цидными и инсектицидными св-вами (см.
Аллилизотиоциа-нат, Метилизотиоцианат).
И. раздражают слизистые
оболочки и кожу.
===
Исп. литература для статьи «ТИОЦИАНАТЫ ОРГАНИЧЕСКИЕ»: Общая органическая
химия, пер. с англ., т. 5, М., 1983, с. 473-79, 673-84; Houben-Weyl, Methoden
der organischen Cbemie, Bd E4, Stuttg.-N. Y., 1983, S. 940-69. А. А. Дудинов.
Страница «ТИОЦИАНАТЫ ОРГАНИЧЕСКИЕ» подготовлена по материалам химической энциклопедии.
|

