|
ТОДДА-АТЕРТОНА РЕАКЦИЯ
(р-ция Атертона), фосфорилирование аминов или NH3 диорганофосфитами
в среде галогенуглеродов или полигалогенир. углеводородов, напр.:
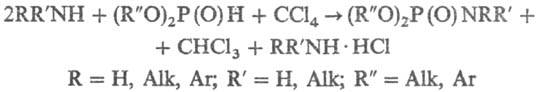
Фосфорилирование низкоосновных
аминов (напр., анилина) ведут в присут. более сильных оснований [напр., (C2H5)3N].
В присут. третичных аминов фосфорилируются также спирты, фенолы и др.
Р-цию обычно проводят в
среде ССl4, С2Сl5Н или СВrСl3 (иногда
в смеси с инертным р-рителем- ксилолом, толуолом и др.) при комнатной т-ре или
при натр. (40-60 °С, 1-2 ч). В реактор сначала вносят фосфорилирующий агент
и затем при перемешивании прикапывают реагент, подлежащий фосфорилированию [если
амин низкоосновный, то используют эквимолярную смесь этого амина и (C2H5)3N].
Газообразные амины (NH3, CH3NH2 и др.) барботируют
в р-р. Р-цию можно осуществить также в условиях межфазного катализа. Выходы
60-95%.
Механизм р-ции полностью
не выяснен. Установлено, что на первой стадии образуется хлорангидрид соответствующего
эфира фосфористой к-ты (В-основание):
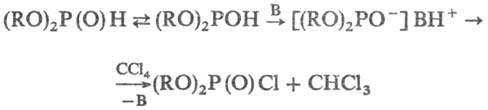
На второй стадии имеет
место собственно фосфорилирование амина хлорангидридом. Первая стадия процесса
идет лишь в присут. сильных оснований.
В р-цию, подобную Т.-А.
р., вступают практически все соед. типа XYP(О)H (X,
Y = Alk, Ar, OR, NR2), а также фосфорноватистая к-та и ее эфиры
(см. Гипофосфиты органические).
В условиях Т.-А. р. нек-рые
производные тиокислот фосфора типа Х2Р(S) H образуют соответствующие
тиофос-форильные соед.; моноорганоамиды диалкилфосфористых к-т и вторичные амины
образуют фосфазосоединения:
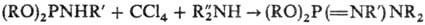
Т.-А. р. широко используют
в препаративной практике. Она открыта в 1945 Ф. Атертоном, X. Опеншоу и А. Тоддом.
===
Исп. литература для статьи «ТОДДА-АТЕРТОНА РЕАКЦИЯ»: Пурдела Д.,
Вылчану Р., Химия органических соединений фосфора, пер. с рум., М., 1972, с.
381-453; Нифантьев Э.Е. [и др.], "Ж. общей химии", 1974, т. 44,
в. 1, с. 108-11; Общая органическая химия, пер. с англ., т. 5, М., 1983, с.
53-56. Г. И. Дрозд.
Страница «ТОДДА-АТЕРТОНА РЕАКЦИЯ» подготовлена по материалам химической энциклопедии.
|

