|
ТОРИЙ (от имени
бога грома Тора в сканд. мифологии; лат. Thorium) Th, радиоактивный хим. элемент
III гр. периодич. системы, ат. н. 90, ат. м. 232,0381; относится к актиноидам.
Стабильных изотопов не имеет. Известно 24 изотопа с мае. ч. 213-236. Наиб.
долгоживущие изотопы 230Th (T1/27,5·104
лет, a-излучатель) и 232Th (T1/2 1,4·1010
лет, a-излучатель), являющийся родоначальником радиоактивного ряда
232Th. В природе распространен изотоп 232Th; содержание
в земной коре 8·10-4% по массе, в морях и океанах 10-9
г/л, в каменных метеоритах 4·10 %. Известно ок. 120 минералов, из к-рых основные-торит
ThSiO4, торианит (Th,U)O2; главный пром. источник -монацит
(Се, La, Th) PO4 (до 12% ThO2). Т. содержится также в
ильменитовых, рутиловых, касситеритовых рудах и рудах РЗЭ. В природе встречается
и 230Тh-один из продуктов распада U. Пром. запасы Т. к нач. 1980-х
гг. оценивались в 1 млн. т. Осн. месторождения расположены в Индии, Канаде,
США, Норвегии, Бразилии.
Конфигурация внеш. электронных
оболочек атома 5f76s26p66d27s2;
наиб. устойчивая степень окисления +4, реже + 2 и +3; электроотрицательность
по Полингу 1,11; атомный радиус 0,1798 нм, ионный радиус Th4+ 0,0984
нм.
Свойства. Т.-серебристо-белый
пластичный металл. Известен в двух полиморфных модификациях: ниже 1360°С
устойчива a-форма с гранецентрир. кубич. решеткой, а = 0,50842 нм;
в интервале 1360-1750 °С устойчива b-fоr-ма с объемноцентрир.
кубич. решеткой, a = 0,411 нм; DH перехода a :
b 3,5 кДж/моль. Т. пл. 1750°С, т. кип. 4200 °С; плотн. И,724 г/см3;
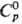 26,23 Дж/(моль·К); 26,23 Дж/(моль·К);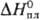 14 кДж/моль,
14 кДж/моль,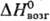 597
кДж/моль; 597
кДж/моль;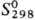 51,83
Дж/(моль · К); ур-ния
температурной зависимости давления пара: для металлического Т. lgp(мм
рт. ст.) = -28780/T+5,991 в интервале 1757-1956 К, для жидкого Т. lgp(мм
рт.ст.) = = -29770/T+ 6,024 в интервале 2020-2500 К; коэф. линейного
расширения 12,5·10-6 К-1 (298-1273 К); r 1,57 x
x 10-3 Ом·см, температурный коэф. r 3,6·10-3
К-1; теплопроводность 0,62 Вт/(см·К); модуль сдвига 28,1 ГПа, модуль
упругости 703 МПа; коэф. Пуассона 0,265; сверхпроводник ниже 1,4 К. Образует
сплавы со мн. металлами. 51,83
Дж/(моль · К); ур-ния
температурной зависимости давления пара: для металлического Т. lgp(мм
рт. ст.) = -28780/T+5,991 в интервале 1757-1956 К, для жидкого Т. lgp(мм
рт.ст.) = = -29770/T+ 6,024 в интервале 2020-2500 К; коэф. линейного
расширения 12,5·10-6 К-1 (298-1273 К); r 1,57 x
x 10-3 Ом·см, температурный коэф. r 3,6·10-3
К-1; теплопроводность 0,62 Вт/(см·К); модуль сдвига 28,1 ГПа, модуль
упругости 703 МПа; коэф. Пуассона 0,265; сверхпроводник ниже 1,4 К. Образует
сплавы со мн. металлами.
Т. весьма реакционноспособен;
порошкообразный-пиро-форен, тускнеет на воздухе, в кипящей воде покрывается
пленкой ThO2. Быстро раств. в 6 М соляной к-те, медленно-в разб.
HF, HNO3, H2SO4 и конц. H2SO4,
пассивируется конц. HNO3, не реагирует со щелочами. При нагревании
Т. в атмосфере Н2
при 400-600 °С образуется гидрид ThH2- темно-серые кристаллы
с тетрагон. решеткой (а = 0,5734 нм, с = 0,4965 нм), плотя. 9,20
г/см3,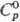 36,71 Дж/(моль·К),
36,71 Дж/(моль·К), 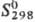 50,73 Дж/(моль·К), разлагается водой,
при действии р-ров к-т выделяет Н2, при 900 °С в вакууме разлагается
с образованием тонкодисперсного Т. При нагревании Т. с Н2 при 250-320
°С получают Th.Hi5-кристаллы с кубич. решеткой (а = 0,9116 нм),
50,73 Дж/(моль·К), разлагается водой,
при действии р-ров к-т выделяет Н2, при 900 °С в вакууме разлагается
с образованием тонкодисперсного Т. При нагревании Т. с Н2 при 250-320
°С получают Th.Hi5-кристаллы с кубич. решеткой (а = 0,9116 нм), 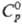 51,32 ДжДмоль · К),
51,32 ДжДмоль · К), 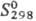 54,42 Дж/(моль · К). Св-ва нек-рых
соединений Т. приведены в табл.
54,42 Дж/(моль · К). Св-ва нек-рых
соединений Т. приведены в табл.
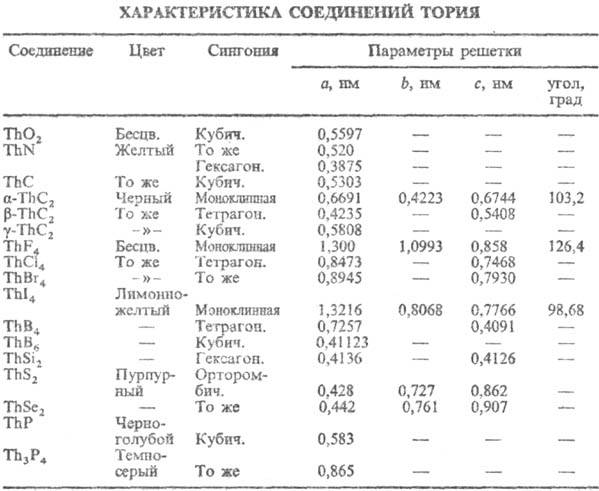
Диоксид ТiO2
имеет т.пл. 3350°С, т. кип. 4400 °С; плотн. 10 г/см3; 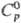 61,76 ДжДмоль · К);
61,76 ДжДмоль · К); 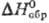 —1226,4 кДж/моль;
—1226,4 кДж/моль; 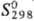 65,23 Дж/(моль · К); ур-ние температурной зависимости давления пара: lgp(мм
рт. ст.) =-3,16·104/T+7,20; реагирует с оксидами металлов
при 600-800 °С, образуя двойные оксиды (тораты), напр. К2ТhO3,
BaThO3, ThGeO4, ThTi2O6, Th3V4O16,
ThM4O12 и Th2M2O9, где
М = Nb, Та; устойчив к действию к-т и восстановителей; образуется при сгорании
металла на воздухе, взаимод. гидрида Th с О2 или Н2О при
100°С, прокаливании гидроксида, пероксида, нитрата, оксалата, карбоната
и др. солей Т.
65,23 Дж/(моль · К); ур-ние температурной зависимости давления пара: lgp(мм
рт. ст.) =-3,16·104/T+7,20; реагирует с оксидами металлов
при 600-800 °С, образуя двойные оксиды (тораты), напр. К2ТhO3,
BaThO3, ThGeO4, ThTi2O6, Th3V4O16,
ThM4O12 и Th2M2O9, где
М = Nb, Та; устойчив к действию к-т и восстановителей; образуется при сгорании
металла на воздухе, взаимод. гидрида Th с О2 или Н2О при
100°С, прокаливании гидроксида, пероксида, нитрата, оксалата, карбоната
и др. солей Т.
Гидроксид Th(ОН)4
- аморфное в-во; устойчив при 260-450 °С, выше 470 °С превращ. в ThO2;
раств. в воде (5·10-7 моль/л); получают взаимод. солей Т. с р-рами
щелочей при рН 3,5-3,6.
Мононитрид ThN (т. пл.
2630°С) получают при взаимод. металлического Т. с NH3 или ThO2
с Mg в атмосфере N2. Нитрид Th2N3 синтезирован
при взаимод. ThH2 с NH3 или N2 при 1000°С;
устойчив в атмосфере N2 при 1730°С; при 1500°С в вакууме
выделяет N2 с образованием ThN2.
Монокарбид ThC имеет т.
пл. 2625 °С;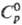 45,14 Дж/(моль · К);
45,14 Дж/(моль · К); 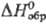 -125,5 кДж/моль;
-125,5 кДж/моль;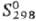 57,93 Дж/(моль · К);
получают взаимод. металлического Т. со стехиометрич. кол-вом С. Дикарбид ThC2
существует в трех полиморфных модификациях: при комнатной т-ре устойчива a-форма
с моноклинной решеткой, в интервале 1430-1480 °С-р-форма с тетрагон. решеткой,
выше 1480°С-g-форма с кубич. решеткой; т. пл. 2655 °С, т. кип.
5000 °С;
57,93 Дж/(моль · К);
получают взаимод. металлического Т. со стехиометрич. кол-вом С. Дикарбид ThC2
существует в трех полиморфных модификациях: при комнатной т-ре устойчива a-форма
с моноклинной решеткой, в интервале 1430-1480 °С-р-форма с тетрагон. решеткой,
выше 1480°С-g-форма с кубич. решеткой; т. пл. 2655 °С, т. кип.
5000 °С; 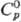 53,63 Дж/(моль · К); —
125,5 кДж/моль;
53,63 Дж/(моль · К); —
125,5 кДж/моль; 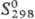 68,46 Дж/(моль · К); разлагается водой
и разб. к-тами с образованием углеводородов, на воздухе окисляется при 600-700
°С до ThO2; получают взаимод. металлического Т. с избытком углерода
или восстановлением ТhО2 углеродом при 1500°С.
68,46 Дж/(моль · К); разлагается водой
и разб. к-тами с образованием углеводородов, на воздухе окисляется при 600-700
°С до ThO2; получают взаимод. металлического Т. с избытком углерода
или восстановлением ТhО2 углеродом при 1500°С.
Тетрагалогениды ТhНа14
получают при нагр. металлич. Th, ThH2, ThC2 или ThO2
при 300-400 °С с соответствующим На12 или HHal. Тетрафторид ThF4
имеет т. пл. 1100°С,
т. кип. 1650 °С; плотн. 5,71 г/см3;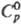 110,709 Дж/(моль ·К);
110,709 Дж/(моль ·К); 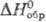 -209,785 кДж/моль;
-209,785 кДж/моль;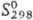 142,047 Дж/(моль·К);
ур-ние температурной зависимости давления пара lgp (мм рт.ст.)= — 16860/Г+
9,105; раств. в воде (0,17 мг/л); образует кристаллогидраты. Тетра-хлорид ThCl4
имеет т. пл. 770°С, т. кип. 921 °С;
142,047 Дж/(моль·К);
ур-ние температурной зависимости давления пара lgp (мм рт.ст.)= — 16860/Г+
9,105; раств. в воде (0,17 мг/л); образует кристаллогидраты. Тетра-хлорид ThCl4
имеет т. пл. 770°С, т. кип. 921 °С;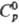 120,290 Дж/(моль·К);
120,290 Дж/(моль·К); 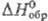 — 118,616 кДж/моль;
— 118,616 кДж/моль;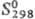 190,372 Дж/(моль·К);
ур-ние температурной зависимости давления пара в интервале 296-1023 К lgp
(мм рт. ст.) = = -11612/T + 10,098; раств. в воде (55,61% по массе
при О °С), низших спиртах, эфирах, ацетоне, не раств. в жидком Сl2,
CS2, CCl4, С6Н6; гигроскопичен,
образует гидраты с 2, 4, 7 и 12 молекулами воды. Тетрабромид ThBr4
имеет т. пл. 679 °С, т. кип. 857 °С; плотн. 5,69 г/см3;
190,372 Дж/(моль·К);
ур-ние температурной зависимости давления пара в интервале 296-1023 К lgp
(мм рт. ст.) = = -11612/T + 10,098; раств. в воде (55,61% по массе
при О °С), низших спиртах, эфирах, ацетоне, не раств. в жидком Сl2,
CS2, CCl4, С6Н6; гигроскопичен,
образует гидраты с 2, 4, 7 и 12 молекулами воды. Тетрабромид ThBr4
имеет т. пл. 679 °С, т. кип. 857 °С; плотн. 5,69 г/см3;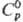 125,19 Дж/(моль · К);
125,19 Дж/(моль · К); 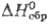 - 964,412 кДж/моль;
- 964,412 кДж/моль;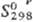 228,028 Дж/(моль ·
К); ур-ние температурной зависимости давления пара lgр (мм рт.ст.)= —
9628/Т+8,85; образует гидраты с 7, 8, 10 и 12 молекулами воды, сольваты-с
NH3, аминами, ацетонитрилом, трифенилфосфиноксидом. Тетраиодид ThI4
имеет т. пл. 566°С, т. кип. 837°С;
228,028 Дж/(моль ·
К); ур-ние температурной зависимости давления пара lgр (мм рт.ст.)= —
9628/Т+8,85; образует гидраты с 7, 8, 10 и 12 молекулами воды, сольваты-с
NH3, аминами, ацетонитрилом, трифенилфосфиноксидом. Тетраиодид ThI4
имеет т. пл. 566°С, т. кип. 837°С; 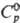 126,650 Дж/(моль·К);
126,650 Дж/(моль·К); 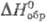 -670,695 кДж/моль;
-670,695 кДж/моль; 255,224 Дж/(моль ·
К); ур-ние температурной зависимости давления пара lgp (мм рт. ст.) =
— 6893/T + 9,09; разлагается с выделением I2 при нагр. и действии
света, хорошо раств. в воде с образованием гидратов.
255,224 Дж/(моль ·
К); ур-ние температурной зависимости давления пара lgp (мм рт. ст.) =
— 6893/T + 9,09; разлагается с выделением I2 при нагр. и действии
света, хорошо раств. в воде с образованием гидратов.
Бориды ThB4
и ThB6 получены взаимод. ThO2 и В при нагр., дисилицид
ThSi2 -нагреванием ThO2 с Si, дисульфид ТhS2-р-Цией
H2S с галогенидами или гидридами Т., серы с металлическим Т. или
ThСl2 и CS, с ThO2, д нее лени д ThSe2-взаимод.
Th и Se при 700 °С; фосфиды ThP4 и Тh3Р4-при
нагр. ThCl4 с парами P или ThH2 с РН3.
Стандартный окислит. потенциал
для Тh0/Тh4+ 1,9 В. В водных р-рах Т. существует обычно
в степени окисления +4, в комплексных соед., как правило, степень окисления
+2 и +3. Ионы Т. в р-ре склонны к гидролизу с образованием гидроксо-ионов [Th(OH)3]+,
[Th2(OH)2]6+, [Th4(OH)12]4+
и комплексообразованию. Известны комплексы Т. в р-рах с фторид-, иодат-, бромат-,
нитрат-, хлорид-, хлорат-, сульфат-, сульфит-, карбонат-, фосфат-, пирофосфат-,
молибдат-ионами, с анионами орг. к-т (муравьиной, уксусной, щавелевой, винной
и др.). Т. образует устойчивые хелаты с 1,3-дикетонами, купфероном и 8-гид-роксихинолином,
к-рые не раств. в воде, но раств. в орг. р-рителях.
Получение. При выделении
Т. монапитовые концентраты подвергаются сернокислотному или щелочному вскрытию.
Для отделения сопутствующих элементов (РЗЭ и др.) используют экстракцию (с трибутилфосфатом)
и сорбцию. Т. выделяют в виде ThO2, ThCl4 либо ThF4
(получают соотв. хлорированием или фторированием ThO2). Металлический
Т. получают из ThO2, ThF4 или ThCl4 восстановлением
Са, Mg или Na при 900-1000 °С, электролизом ThF4 или KThF5
в расплаве галогенидов щелочных металлов при 800 °С и плотности тока на
графитовом аноде 0,5 А/дм2.
Применение. Т. используют
для легирования магниевых и др. сплавов, как геттер при изготовлении электроламп.
ThO2-огнеупорный материал, компонент катализаторов, перспективное
ядерное топливо в уран-то-риевых реакторах, в к-рых 232Тh превращ.
в 233U по р-ции:
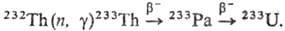 Изотоп 230Th-источник
Изотоп 230Th-источник
a-излучения, 228Th
используют для получения торона (220Rn), а изотопы 234Тh
и 229Th-изотопные индикаторы. См. также Ядерный топливный цикл.
Токсичен, ПДК 0,05 мг/м3.
Впервые Т. выделен И. Берцелиусом
в 1828 из минералов, известных теперь как ториты.
Лит · Торий, пер.
с англ., М., 1962; Chemistry of the actinide elements, 2 ed., v. 1 -2, L.-N.Y.,
1986. Б.Ф. Мясоедов.
===
Исп. литература для статьи «ТОРИЙ»: нет данных
Страница «ТОРИЙ» подготовлена по материалам химической энциклопедии.
|

