|
ТРАНСАННУЛЯРНЫЕ РЕАКЦИИ
(от лат. trans-через, за пределами и annulus-колечко), осуществляются между
несвязанными между собой атомами средних циклов (С8-С11),
находящимися на противоположных сторонах кольца, но сближенными в пространстве.
Обусловлены характерными для средних циклов конформациями, в к-рых нек-рые связи
углеродных атомов направлены внутрь кольца (интрааннулярные связи). Т. р. сопровождаются
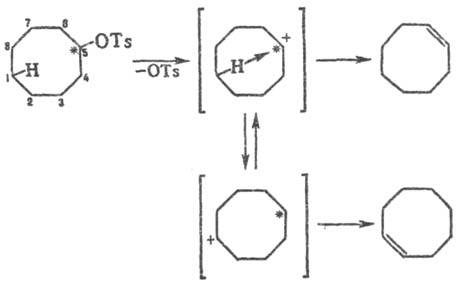
перескоком пространственно сближенного атома H к положительно заряженному
атому С (гидридный переход). Такой переход проявляется, напр., при сольволизе
и дегидратации меченого 14С-циклооктанолтозилата, когда меченый атом
оказывается в положениях 5, 6 или 7 (Ts = n-CH3C6H4SO2).
При этом двойная связь возникает не только у того атома С, где был заместитель,
но и на противоположной стороне цикла:
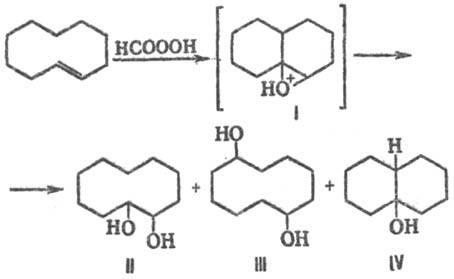
Т. р. наблюдаются также
при окислении среднециклич. олефинов, напр. транс-циклодецена надмуравьиной
к-той; в результате гидридного перехода интрааннулярных атомов H к карбкатионному
центру в промежуточном катионе I кроме "нормального" продукта II
образуются трансанну-лярные продукты III и IV:
'
Другой тип Т. р.-циклизация
циклополиенов (интрамол. диеновый синтез). Так, циклооктатриен и его аналоги
находятся в таутомерном равновесии с соответствующим бициклич. соединением.
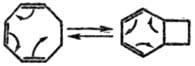
Это редкий вид таутомерии,
при к-рой происходит лишь перераспределение электронной плотности без переноса
к.-л. атомов.
Т. р. стереоспецифичны:
если в качестве исходного в-ва взят определенный пространств. изомер, то продуктом
р-ции, как правило, будет также изомер определенного пространств. строения.
В "ряде среднециклич.
соед. между группами, противостоящими друг другу, отмечены трансаннулярные взаимодействия
(Т. в.), способные значительно понижать конфор-мац. подвижность циклоалканов
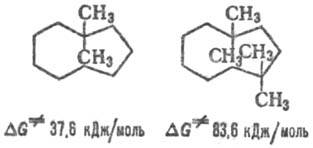
в осн. благодаря затруднениям, создаваемым для псевдовращений молекулы. Напр.,
величины инверсионных барьеров (DG.) для 1,1-диметил-циклононана
на 12,5 кДж/моль больше, чем для незамещ. циклононана, а для 1,1,4,4-тетраметилпроизводного,
в молекуле к-рого взаимодействующие группы СН3 расположены напротив
друг друга, DG. возрастает более чем в 3 раза:
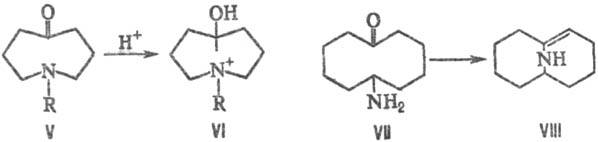
Т. в. объясняется образование
соед. VI при попытке получения аммониевой соли из аминокетона V, при этом протон
атакует не атом азота, а карбонильную группу; в результате образования мостика
между двумя кольцами уменьшается энергия напряжения молекулы. Подобным образом
амин VII легко превращается в бициклич. енамин VIII:
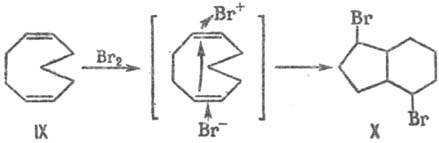
При электроф. присоединении
брома к (1Z, 5Z)-циклоно-надиену IX благодаря трансаннулярному участию
пространственно сближенной второй двойной связи образуется аддукт X.
Для нек-рых циклич. аминокетонов,
содержащих ацило-иновую группировку, Т. в. карбонильной и аминогрупп проявляется
в понижении основности амина и смещении частоты группы СО в ИК спектре. Проявления
Т. в. обнаруживаются также в соед. циклогексанового (взаимод. заместителей в
положениях 1 и 4), гетероциклич. рядов и др.
Г. В. Гришина,
===
Исп. литература для статьи «ТРАНСАННУЛЯРНЫЕ РЕАКЦИИ»: нет данных
Страница «ТРАНСАННУЛЯРНЫЕ РЕАКЦИИ» подготовлена по материалам химической энциклопедии.
|

