|
УГЛЕРОД
(Carboneum) C, хим. элемент IV гр. периодич. системы, ат. н. 6, ат.м. 12.011.
Природный У. состоит из двух стабильных изотопов - 12C (98,892%)
и 13C (1,108%). Сечение захвата тепловых нейтронов 3,5·10-31
м2. В атмосфере присутствует радиоактивный нуклид 14C.
Он постоянно образуется в ниж. слоях стратосферы в результате воздействия нейтронов
космич. излучения на ядра азота по р-ции: 14N (n, р)14C.
Конфигурация внеш. электронной оболочки атома У. 2s22p2;
степени окисления +4, -
4, редко +2 (СО, карбонилы металлов), +3 (C2N2, галоген-цианы);
сродство к электрону 1,27 эВ; энергий ионизации при последоват. переходе от
С° к C4+ соотв. 11,26040, 24,383, 47,871 и 64,19 эВ; электроотрицательность
по Полингу 2,5; атомный радиус 0,077 нм, ионный радиус C4+ (в скобках
даны координац. числа) 0,029 нм (4), 0,030 нм (6).
Содержание У. в земной
коре 0,48% по массе. Свободный У. находится в природе в виде алмаза и
графита. Осн. масса У. встречается в виде карбонатов природных (известняки
и доломиты), горючих ископаемых - антрацит (94-97% С), бурые угли
(64-80% С), каменные угли (76-95% С), горючие сланцы (56-78%
С), нефть (82-87% С), газы природные горючие (до 99% CH4),
торф (53-62% С), а также битумы и др. В атмосфере и гидросфере
У. находится в виде углерода диоксида CO2, в воздухе 0,046%
CO2 по массе, в водах рек, морей и океанов в ~ 60 раз больше. У.
входит в состав растений и животных (~18%). Кругооборот У. в природе включает
биол. цикл, выделение CO2 в атмосферу при сгорании ископаемого топлива,
из вулканич. газов, горячих минер. источников, из поверхностных слоев океанич.
вод и др. Биол. цикл состоит в том, что У. в виде CO2 поглощается
из тропосферы растениями, затем из биосферы вновь возвращается в геосферу: с
растениями У. попадает в организм животных и человека, а затем при гниении животных
и растит, материалов - в почву и в виде CO2 - в атмосферу.
В парообразном состоянии
и в виде соед. с азотом и водородом У. обнаружен в атмосфере Солнца, планет,
он найден в каменных и железных метеоритах.
Большинство соединений
У., и прежде всего углеводороды, обладают ярко выраженным характером
ковалентных соединений. Прочность простых, двойных и тройных связей атомов У.
между собой, способность образовывать устойчивые цепи и циклы из атомов С обусловливают
существование огромного числа углеродсодержащих соед., изучаемых органической
химией.
Свойства. Основные и хорошо
изученные кристаллич. модификации У.- алмаз и графит. При нормальных условиях
термодинамически устойчив только графит, а алмаз и др. формы метастабильны.
При атм. давлении и т-ре выше 1200 К алмаз начинает переходить в графит, выше
2100 К превращение совершается за секунды; DH° перехода -1,898
кДж/моль. При нормальном давлении У. сублимируется при 3780 К. Жидкий У. существует
только при определенном внеш. давлении. Тройные точки: графит - жидкость -пар
T =4130 К, р=12 МПа; графит - жидкость - алмаз T=4100,
p =12,5 ГПа. Прямой переход графита в алмаз происходит при 3000 К и давлении
11-12 ГПа.
При давлениях выше 60 ГПа
предполагают образование весьма плотной модификации У. III (плотность на 15-20%
выше плотности алмаза), имеющей металлич. проводимость. При высоких давлениях
и относительно низких т-рах (ок. 1200 К) из высокоориентир. графита образуется
гексагон. модификация У. с кристаллич. решеткой типа вюрцита -лонсдейлит (а
= 0,252 HM, с =0,412 нм, пространств. группа
Р63/ттс), плотн. 3,51 г/см3, т. е. такая же, как
у алмаза. Лонсдейлит найден также в метеоритах.
Кристаллич. модификация
У. гексагон, сингонии с цепочечным строением молекул наз. к а р б и н. Цепи
имеют либо полииновое строение 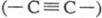 , либо поликумуленовое
, либо поликумуленовое 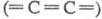 . Известно неск. форм карбина, отличающихся числом атомов в элементарной ячейке,
размерами ячеек и плотностью (2,68-3,30 г/см3). Карбин встречается
в природе в виде минерала чаоита (белые прожилки и вкрапления в графите) и получен
искусственно - окислит, дегидрополи-конденсацией ацетилена, действием лазерного
излучения на графит, из углеводородов или CCl4 в низкотемпературной
плазме.
. Известно неск. форм карбина, отличающихся числом атомов в элементарной ячейке,
размерами ячеек и плотностью (2,68-3,30 г/см3). Карбин встречается
в природе в виде минерала чаоита (белые прожилки и вкрапления в графите) и получен
искусственно - окислит, дегидрополи-конденсацией ацетилена, действием лазерного
излучения на графит, из углеводородов или CCl4 в низкотемпературной
плазме.
В основе строения аморфного
У. лежит разупорядоченная структура мелкокристаллич. (всегда содержит примеси)
графита. Это кокс (см. Кокс каменноугольный, Кокс нефтяной, Кокс пековый),
бурые и каменные угли, сажа (см. Технический углерод), активный уголь.
У. известен также в виде кластерных частиц C60 и C70
(фуллерены).
При обычных т-рах У. химически
инертен, при достаточно высоких соединяется со мн. элементами, проявляет сильные
восстановит. св-ва. Хим. активность разных форм У. убывает в ряду: аморфный
У., графит, алмаз, на воздухе они воспламеняются при т-рах соотв. выше 300-500
0C, 600-700 0C и 850-1000 0C. Продукты горения
- углерода оксид СО и диоксид CO2. Известны также неустойчивый
оксид C3O2 (т. пл. -111 0C, т. кип. 7 0C)
и нек-рые др. оксиды. Графит и аморфный У. начинают реагировать с H2
при 1200 0C, с F2 - соотв. выше 900 0C и при
комнатной т-ре. Графит с галогенами, щелочными металлами и др. в-вами образует
соединения включения (см. Графита соединения). При пропускании электрич.
разряда между угольными электродами в среде N2 образуется циан,
при высоких т-рах взаимодействием У. со смесью H2 и N2
получают синильную кислоту. С серой У. дает сероуглерод CS2,
известны также CS и C3S2. С большинством металлов, В и
Si У. образует карбиды. Важна в пром-сти р-ция У. с водяным паром С +
H2O СО + H2 (см. Газификация твердых топлив). При нагревании У.
восстанавливает оксиды металлов до металлов, что широко используется в металлургии.
СО + H2 (см. Газификация твердых топлив). При нагревании У.
восстанавливает оксиды металлов до металлов, что широко используется в металлургии.
О применении У. см. вышеперечисл.
статьи, а также см. Углеграфитовые материалы, Углепластики и др.
У. входит в состав атм.
аэрозолей, в результате чего может изменяться региональный климат, уменьшаться
кол-во солнечных дней. Частицы У. поглощают солнечное излучение, что может вызвать
нагревание пов-сти Земли. У. поступает в окружающую среду в виде сажи в составе
выхлопных газов автотранспорта, при сжигании угля на ТЭС, при открытых разработках
угля, подземной его газификации, получении угольных концентратов и др. Концентрация
У. над источниками горения 100-400 мкг/м3, крупными городами 2,4-15,9
мкг/м3, сельскими р-нами 0,5-0,8 мкг/м3. С газоаэрозольными
выбросами АЭС в атмосферу поступает (6-15)·109 Бк/сут 14CO2.
Высокое содержание У. в
атм. аэрозолях ведет к повышению заболеваемости населения, особенно верх. дыхат.
путей и легких. Проф. заболевания - в осн. антракоз и пылевой бронхит. В воздухе
рабочей зоны ПДК, мг/м3: алмаз 8,0, антрацит и кокс 6,0, каменный
уголь 10,0, технический У. и углеродная пыль 4,0; в атм. воздухе для сажи макс,
разовая 0,15, среднесуточная 0,05 мг/м3.
Токсич. действие 14C,
вошедшего в состав молекул белков (особенно в ДНК и РНК), определяется радиац.
воздействием b-частиц и ядер отдачи азота 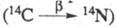 и трансмутац. эффектом - изменением хим. состава молекулы в результате превращения
атома С в атом N. Допустимая концентрация 14C в воздухе рабочей зоны
ДКА 1,3 Бк/л, в атм. воздухе ДКБ 4,4 Бк/л, в воде 3,0·104
Бк/л, предельно допустимое поступление через органы дыхания 3,2· 108
Бк/год.
и трансмутац. эффектом - изменением хим. состава молекулы в результате превращения
атома С в атом N. Допустимая концентрация 14C в воздухе рабочей зоны
ДКА 1,3 Бк/л, в атм. воздухе ДКБ 4,4 Бк/л, в воде 3,0·104
Бк/л, предельно допустимое поступление через органы дыхания 3,2· 108
Бк/год.
У. в виде древесного угля
применялся в глубокой древности для выплавки металлов. Издавна известны алмаз
и графит.
Элементарная природа У.
установлена А. Лавуазье в кон. 1780-х гг.
===
Исп. литература для статьи «УГЛЕРОД»: Химия гиперкоординированного
углерода, пер. с англ., M., 199O, Kirk - Othmer encyclopedia, 3 ed., v.
4, N. Y., 1978, p. 556-709.
Я. А. Калашников.
Страница «УГЛЕРОД» подготовлена по материалам химической энциклопедии.
|

