|
УГЛЕРОДА
ОКСИД (монооксид углерода, угарный газ) СО, мол.м. 28,01; газ без
цвета и запаха. Связь в молекуле СО тройная, длина связи 0,113 HM, энергия диссоциации
1071,78 кДж/моль, 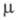 0,4·10-30 Кл·м. T. пл. -205,02 0C, т. кип. -191,50 0C;
tкрит -140,2 0C, ркрит 3,48 МПа;
плотн. 1,25 г/дм3 (0 0C);
0,4·10-30 Кл·м. T. пл. -205,02 0C, т. кип. -191,50 0C;
tкрит -140,2 0C, ркрит 3,48 МПа;
плотн. 1,25 г/дм3 (0 0C); 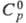 29,14 Дж/(моль·К); DHпл 0,8373 кДж/моль и DHвозг
7,3581 кДж/моль при -205,02 0C и 0,015 МПа, DHисп
6,0342 кДж/моль (-191,50 0C, 0,1 МПа), DH0обр
-110,53 кДж/моль, DHcrop -283,0 кДж/моль;
29,14 Дж/(моль·К); DHпл 0,8373 кДж/моль и DHвозг
7,3581 кДж/моль при -205,02 0C и 0,015 МПа, DHисп
6,0342 кДж/моль (-191,50 0C, 0,1 МПа), DH0обр
-110,53 кДж/моль, DHcrop -283,0 кДж/моль;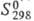 197,55 Дж/(моль·К). Твердый СО кристаллизуется в кубич. решетке (а = 0,563
HM, z = 4, пространств. группа Р213); ниже -211,59
0C существует гексаген, модификация, DH перехода 631,6 Дж/моль.
Р-римость в воде при 0,1 МПа, мл в 100 мл: 3,3 (0 0C), 2,32 (20 0C).
Раств. в этаноле (20,4 мл в 100 мл при 0,25 0C, 0,1 МПа), бензоле,
CH2Cl2, соляной и уксусной к-тах. У. о.- несолеобразующий
оксид. При повыш. т-рах он реагирует с щелочами:
197,55 Дж/(моль·К). Твердый СО кристаллизуется в кубич. решетке (а = 0,563
HM, z = 4, пространств. группа Р213); ниже -211,59
0C существует гексаген, модификация, DH перехода 631,6 Дж/моль.
Р-римость в воде при 0,1 МПа, мл в 100 мл: 3,3 (0 0C), 2,32 (20 0C).
Раств. в этаноле (20,4 мл в 100 мл при 0,25 0C, 0,1 МПа), бензоле,
CH2Cl2, соляной и уксусной к-тах. У. о.- несолеобразующий
оксид. При повыш. т-рах он реагирует с щелочами:
СО + NaOH HCOONa
HCOONa
Однако в образующихся формиатах
и СО природа хим. связи различна, и У. о. нельзя считать ангидридом HCOOH. Эту
р-цию, а также р-ции
Ca(OH)2 + СО CaCO3 + H2, CaC2 + 3CO
CaCO3 + H2, CaC2 + 3CO  CaCO3
+ 4С CaCO3
+ 4С
иногда применяют для удаления
У. о. из техн. газов, напр, при получении чистого H2 из синтез-газа.
У. о. в присут. разл. катализаторов при повыш. т-ре реагирует с NH3,
давая разные продукты. Так, в присут. Pt образуется цианат аммония NH4NCO,
изомеризующийся в мочевину:
СО + 2NH3 H2 + NH4NCO
H2 + NH4NCO CO(NH2)2 CO(NH2)2
В присут. дегидратирующих
катализаторов получают NH4CN:
СО + 2NH3 NH4CN + H2O
NH4CN + H2O
У. о.- сильный восстановитель.
Восстановление оксидов металлов до металлов с помощью СО имеет большое значение
в металлургии. У. о. склонен к р-циям присоединения. С Cl2 (в присут.
катализатора или под действием света) образует фосген COCl2, с S
(при нагр.) - COS, с металлами - карбо-нилы металлов Мх(СО)у.
У. о. образует комплексные соед. с нек-рыми солями. Одни из них [OsCl2(CO)3,
PtCl2(CO) и др.] м. б. получены в твердом состоянии, другие [AgSO4(CO),
CuCl(CO) и др.] устойчивы только в р-ре. В присут. катализаторов, содержащих
Pd или Pt, У. о. полностью окисляется до CO2, что используется для
удаления СО из выхлопных газов автомобилей.
Весьма разнообразны продукты
взаимод. СО и H2, состав к-рых зависит от т-ры, давления и катализатора.
Так м. б. синтезированы метан и др. углеводороды парафинового ряда (см. Фишера
- Транша синтез), спирты, альдегиды, кетоны, орг. к-ты. Особенно важно в
пром-сти получение метанола:
СО + 2H2 CH3OH
CH3OH
См. также Гаттермана
- Коха реакция, Гидроформилирова-ние, Карбонилирование, Реппе реакции.
У. о. в составе горючих
газов получают газификацией твердых топлив:
С + 0,5O2 СО
СО
С + CO2 2CO C + H2O
2CO C + H2O СО+
H2 СО+
H2
газификацией нефтяных
остатков:
CH4+ 0,5O2 СО+ 2H2 CH4+ H2O
СО+ 2H2 CH4+ H2O СО+3H2 СО+3H2
При использовании в качестве
окислителя парокислородной смеси образуется синтез-газ. В лаборатории У. о.
удобно получать дегидратацией HCOOH конц. H2SO4 или P2O5:
HCOOH СО+ H2O
СО+ H2O
У. о.- высококалорийное
топливо, одно из осн. исходных B-B в орг. синтезе (при получении спиртов, альдегидов,
кето-нов, углеводородов, карбоновых к-т и др.), восстановитель в металлургии
(напр., при выплавке чугуна и стали).
Естеств. уровень СО в атмосфере
0,01-0,9 мг/м3. В атмосферу СО попадает в составе вулканич. и болотных
газов, в результате лесных и степных пожаров, выделения микроорганизмами, растениями,
животными и человеком и др. Из поверхностных слоев океана в год выделяется 220·106
т СО в результате фоторазложения красных, синезеленых и др. водорослей, продуктов
жизнедеятельности планктона. В результате деятельности человека в атмосферу
ежегодно поступает (350-600)·106 т СО, более половины этого кол-ва
(56-62%) приходится на долю автотранспорта, причем содержание СО в выхлопных
газах может достигать 12%. Для их очистки от СО на автомобилях устанавливают
катализаторы дожигания. У. о. выделяется в атмосферу в результате неисправности
газопроводов и газоаппаратуры, неполного сгорания топлива, в металлургич. процессах
(при выплавке 1 млн. т стали выбрасывается в атмосферу 320-400 т СО), в хим.
пром-сти (установки крекинга, произ-во формалина, углеводородов, NH3
и др.). Высока концентрация СО в угольных шахтах, на углеподающих трассах; угольная
пыль содержит 0,1-3,9% СО. В выхлопных газах дизельных двигателей тепловозов
содержится 70-93 мг/м3 СО, морских судов - до 70-80 мг/м3,
в значит, кол-ве СО содержится в выбросах самолетов.
У. о.- яд. Он соединяется
с гемоглобином и миоглобином, нарушая тканевое дыхание и вызывая кислородное
голодание тканей, особенно клеток центр, нервной системы. ПДК СО (мг/м3):
в воздухе рабочей зоны - 20,0 в течение рабочего дня, 50,0 - 60 мин, 100,0 -
30 мин, 200,0 - 15 мин; в атм. воздухе макс, разовая 5,0, среднесуточная 3,0.
KПB в смеси с воздухом 12,5-74,2%; смесь CO:O2 = 2:1 (по объему)
взрывается при зажигании.
Хранят СО в баллонах красного
цвета. я. А. Калашников.
===
Исп. литература для статьи «УГЛЕРОДА ОКСИД»: нет данных
Страница «УГЛЕРОДА ОКСИД» подготовлена по материалам химической энциклопедии.
|

