|
УРАНА
ОКСИДЫ: UO2, U3O8, U4O9
и UO3. Д и о к с ид UO2 (минерал
ураниниг) - черно-коричневые кристаллы (табл.); при 30,44 К происходит фазовый
переход парамагнетик-->антиферромагнетик; начиная с ~ 2000 К наблюдается
аномальный рост теплоемкости; температурный коэф. линейного расширения 9,3·10-6K-1
(293-373 К), 1,08·10-4K-1 (1173-1273 К); твердость по
Моосу 6-7; в воде не раств., не взаимод. с H2, СО, газообразным HCl;
с CCl4 в присут. CS2 при 450 0C образует UCl4;
в атмосфере O2 при т-ре ниже 250 С образует оксиды состава UO2+x
(х = 0-3,34). Получают UO2 восстановлением U3O8
или UO3 водородом при т-ре выше 500 0C, термич. разложением
UO2C2O4 или (NH4)2[UO2(CO3)3]
в восстановит. или инертной атмосфере восстановлением UO2F2
влажным H2. UO2, обогащенный 235U,- ядерное
топ-ливо; минерал - исходное в-во в произ-ве U, UF4 и др. соед. урана.
ХАРАКТЕРИСТИКА ОКСИДОВ
УРАНА
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Плотн., г/см?
(рентгеновская)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
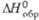 , кДж/моль
, кДж/моль
|
|
|
|
|
|
|
|
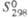 , Дж/(моль · К)
, Дж/(моль · К)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
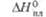 78 кДж/моль;
78 кДж/моль; 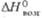 605 кДж/моль (0 К). б Т-ра разложения. в Угол
605 кДж/моль (0 К). б Т-ра разложения. в Угол 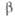 = 99,03°. г Т-ра начала диссоциации на воздухе;
= 99,03°. г Т-ра начала диссоциации на воздухе; 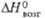 424
кДж/моль (0 К). д Экспериментальная. 424
кДж/моль (0 К). д Экспериментальная.
Октаоксид триурана U3O8
(минерал настуран) -зелено-черные кристаллы; до 210 0C существует
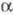 -U3O8
с ромбич. решеткой, выше 210 0C - b-форма с ромбич. решеткой
(а = 0,7068 нм, b =1,1445 нм, с = 0,8303 нм, пространств, группа
Стст), по др. данным - с гексаген, решеткой; предполагают существование
и др. модификаций. U3O8 не раств. в воде; получают его
термич. разложением мн. кислородсодержащих соед. U (кроме фосфатов) выше 500
0C или окислением UO2. Октаоксид - осн. компонент урановых
хим. концентратов, весовая форма при количеств, определении урана. -U3O8
с ромбич. решеткой, выше 210 0C - b-форма с ромбич. решеткой
(а = 0,7068 нм, b =1,1445 нм, с = 0,8303 нм, пространств, группа
Стст), по др. данным - с гексаген, решеткой; предполагают существование
и др. модификаций. U3O8 не раств. в воде; получают его
термич. разложением мн. кислородсодержащих соед. U (кроме фосфатов) выше 500
0C или окислением UO2. Октаоксид - осн. компонент урановых
хим. концентратов, весовая форма при количеств, определении урана.
При термич. разложении
U3O8, начиная с 1500 0C, в равновесии с O2
при атм. давлении находится нанооксид тетраурана U4O9.
Триоксид урана UO3-
кристаллич. или аморфное в-во от светло-желтого до оранжевого цвета; существует
в след, полиморфных модификациях: 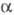 с ромбич. решеткой (а = 0,684 нм, b = 4,345 нм, с = 0,4157
нм),
с ромбич. решеткой (а = 0,684 нм, b = 4,345 нм, с = 0,4157
нм), 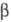 с
моноклинной решеткой, с
моноклинной решеткой,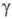 с
ромбич. решеткой (а = 0,9813 нм, b = 1,993 нм, с = 0,9711 нм), с
ромбич. решеткой (а = 0,9813 нм, b = 1,993 нм, с = 0,9711 нм),
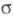 с кубич.
решеткой (а = 0,416 нм), с кубич.
решеткой (а = 0,416 нм), 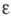 с трикл инной решеткой (а = 0,4002 нм, b = 0,3 841 нм, с
= 0,4165 нм,
с трикл инной решеткой (а = 0,4002 нм, b = 0,3 841 нм, с
= 0,4165 нм, 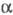 =98,10°, =98,10°,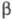 =90,20°, =90,20°,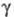 =120,17°)
и =120,17°)
и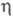 с ромбич.
решеткой (а = 0,7511 нм, b = 0,5466 нм, с = 0,5224 нм); на образование
той или иной модификации оказывают влияние структура исходного в-ва и условия
получения. UO3 образует гидраты, разлагается на воздухе при 400 С,
восстанавливается H2 выше 500 0C до UO2. Получают
его разложением нитрата уранила UO2(NO3)2 при
500 0C, пероксида UO4(H2O)n при
400-500 0C или гидратов при 450 0C. Применяют как компонент
пигментов. с ромбич.
решеткой (а = 0,7511 нм, b = 0,5466 нм, с = 0,5224 нм); на образование
той или иной модификации оказывают влияние структура исходного в-ва и условия
получения. UO3 образует гидраты, разлагается на воздухе при 400 С,
восстанавливается H2 выше 500 0C до UO2. Получают
его разложением нитрата уранила UO2(NO3)2 при
500 0C, пероксида UO4(H2O)n при
400-500 0C или гидратов при 450 0C. Применяют как компонент
пигментов.
Прокаливанием У. о. с солями
или оксидами щелочных, щел.-зем. или нек-рых переходных металлов получают ура-наты.
Для У. о. ПДК 0,075 мг/м3.
гг. Ф. Мясоедов.
===
Исп. литература для статьи «УРАНА ОКСИДЫ»: нет данных
Страница «УРАНА ОКСИДЫ» подготовлена по материалам химической энциклопедии.
|

