|
ФАЗ ПРАВИЛО, закон,
связывающий число фаз, находящихся в термодинамически равновесной системе, с
числом компонентов системы, числом ее степеней свободы и числом внеш. параметров,
определяющих состояние системы. При этом под фазой подразумевают однородную
по хим. составу и термодинамич. св-вам часть системы, отделенную от др. частей
(фаз) пов-стями раздела. На этих пов-стях скачкообразно меняются св-ва системы
(состав, плотность, параметры кристаллич. решетки и т. п.). Под числом фаз f
понимают кол-во разл. фаз. Напр., вода в равновесии со льдом образует двухфазную
систему; твердая соль в равновесии с ее насыщ. водным р-ром и паром - трехфазную
систему. Газообразные в-ва, как правило, образуют всегда одну фазу (при высоких
давлениях газовые смеси могут расслаиваться с появлением двух фаз). Число фаз
в системе, жидких и особенно кристаллических, вообще говоря, не ограничено,
т. к. жидкости и кристаллич. тела далеко не всегда могут смешиваться в любых
отношениях.
Иногда понятие фазы определяют,
исходя из идентичности не только термодинамических, но всех физ. св-в. Напр.,
в-ва, образующие оптически активные право- и левовращающие кристаллы типа кварца,
NaClO3 (имеется в виду поворот плоскости поляризации света), рассматривают
как две разл. фазы, отличающиеся знаком вращения, кристаллографич. параметрами.
Однако по своим термодинамич. св-вам такие в-ва идентичны и традиционно их считают
одной фазой.
Другой дискуссионный вопрос
- это в-ва с фазовыми превращениями второго рода, к к-рым относятся переходы
типа порядок - беспорядок, магн. превращения в точках Кюри и Нееля, др. превращения
(см. Полиморфизм, Фазовые переходы). В точках переходов второго
рода первые производные термодинамич. потенциалов (энтальпия, уд. объем и т.
п.) не претерпевают разрыва непрерывности, но производные высших порядков (теплоемкость,
сжимаемость) имеют аномалии (разрывы непрерывности). Для данного в-ва такие
точки являются границей локальной устойчивости определенных форм, к-рые могут
находиться в равновесии только в точках перехода (см. Фазовое равновесие).
В рамках классич. термодинамики состояния в-ва, связанные переходом второго
рода, считаются одной фазой.
Числом компонентов k
системы наз. наименьшее число исходных в-в, достаточное для образования всех
фаз данной системы. Число компонентов равно числу исходных в-в, если в системе
исходные в-ва не вступают друг с другом в
хим. р-ции. Если же между исходными в-вами имеют место р-ции, в-ва м. б. связаны
определенными соотношениями (ур-ниями хим. равновесия, начальными условиями);
в этом случае число компонентов равно разности между числом исходных в-в и числом
независимых р-ций между ними. Выбор компонентов произволен, но число компонентов
k -важная характеристика, определяющая св-ва системы. Напр., в системе
из шести солей (NaCl, Na2SO4, NaNO3, KCl, K2SO4,
KNO3) и воды (7-е в-во) имеют место две независимые р-ции обмена:
NaCl+KNO3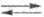 KCl+ NaNO3; Na2SO4 + + 2KCl
KCl+ NaNO3; Na2SO4 + + 2KCl K2SO4
+ 2NaCl. Третья возможная р-ция обмена: Na2SO4 + 2KNO3 K2SO4
+ 2NaCl. Третья возможная р-ция обмена: Na2SO4 + 2KNO3 K2SO4
+ 2NaNO3 не является независимой, т.к. является результатом сложения
двух первых р-ций. Следовательно, число компонентов этой системы к = 7
— 2 = 5. Этот результат не изменится и в том случае, если учесть образующиеся
в этой системе кристаллогидраты или др. в-ва, т. к. с каждым образующимся в-вом
добавляется и связанная с ним р-ция (см. также Многокомпонентные системы). K2SO4
+ 2NaNO3 не является независимой, т.к. является результатом сложения
двух первых р-ций. Следовательно, число компонентов этой системы к = 7
— 2 = 5. Этот результат не изменится и в том случае, если учесть образующиеся
в этой системе кристаллогидраты или др. в-ва, т. к. с каждым образующимся в-вом
добавляется и связанная с ним р-ция (см. также Многокомпонентные системы).
Под числом степеней свободы,
или вариантностью, v системы понимается число параметров состояния, таких,
как давление, т-ра, концентрации в-в, к-рые можно изменять в нек-ром интервале
независимо друг от друга без изменения числа фаз f. Напр., при двухфазном
равновесии воды и насыщенного пара (f = 2), выбрав определенную т-ру, нельзя
произвольно выбирать давление, т. к. каждой т-ре отвечает определенное давление
насыщ. пара (и наоборот, выбрав определенное давление, нельзя произвольно менять
т-ру), т. е. вариантность v = 1.
Внеш. параметры, определяющие
состояние системы и имеющие одно и то же значение для всех фаз системы, наз.
факторами равновесия. Обычно учитывается влияние на систему только двух внеш.
параметров - т-ры и давления. В этом случае Ф. п. наз. правилом фаз Гиббса и
записывается в виде:
v = k - f
+2
Для конденсированных систем,
т. е. состоящих из кристаллич. и жидких фаз (напр., металлич. сплавов), влиянием
давления, если оно не слишком сильно отличается от атмосферного, можно пренебречь,
тогда Ф. п. запишется в виде: v = k - f +1
В нек-рых случаях состояние
системы может определяться большим числом факторов равновесия п, поэтому в общем
виде Ф. п. имеет вид:
v = k — f
+ n
К числу таких факторов
относится, в частности, степень дисперсности (поверхностная энергия), т. к.
давление пара над мелкими каплями больше, чем над крупными, также растворимость
мелких кристаллов выше, чем крупных. К числу внеш. факторов, к-рые могут оказывать
влияние на состояние системы, относятся напряженности полей (элект-рич., магнитного,
гравитационного, упругие напряжения в слитке). Во всех этих случаях n >
2, соотв. число степеней свободы системы больше, чем определенное по обычной
форме Ф. п.
Если равновесное состояние
системы определяется двумя параметрами (в наиб, частом случае т-рой и давлением)
и n — 2, то f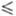 k
+ 2, т. е. макс. число фаз, равновесно сосуществующих в системе, не должно
превышать числа компонентов более, чем на 2. Следовательно, в однокомпонентной
системе макс, число равновесно сосуществующих фаз равно 3, в двойной (двухкомпонентной)
системе - 4 (напр., в системе соль - вода могут сосуществовать кристаллы соли
и льда, насыщ. р-р и пар), в тройной системе 5 и т. д. Если n м. б. больше
2, возможны случаи сосуществования большего числа фаз при строго фиксированных
значениях всех параметров. Очевидно, при макс, числе фаз вариантность системы
v = 0, т.е. система не имеет степеней свободы (система и он вариантна,
или инвариантна). Такое равновесное состояние возможно только при определенных
значениях всех параметров (т-ры, давления, концентрации в-в). Примером является
тройная точка однокомпонентной системы, в к-рой в равновесии находятся, напр.,
кристаллы, расплав и пар. Ей отвечают строго определенные т-ра и давление, изменение
любого из этих параметров приводит к исчезновению одной из фаз (см. Критические
явления). k
+ 2, т. е. макс. число фаз, равновесно сосуществующих в системе, не должно
превышать числа компонентов более, чем на 2. Следовательно, в однокомпонентной
системе макс, число равновесно сосуществующих фаз равно 3, в двойной (двухкомпонентной)
системе - 4 (напр., в системе соль - вода могут сосуществовать кристаллы соли
и льда, насыщ. р-р и пар), в тройной системе 5 и т. д. Если n м. б. больше
2, возможны случаи сосуществования большего числа фаз при строго фиксированных
значениях всех параметров. Очевидно, при макс, числе фаз вариантность системы
v = 0, т.е. система не имеет степеней свободы (система и он вариантна,
или инвариантна). Такое равновесное состояние возможно только при определенных
значениях всех параметров (т-ры, давления, концентрации в-в). Примером является
тройная точка однокомпонентной системы, в к-рой в равновесии находятся, напр.,
кристаллы, расплав и пар. Ей отвечают строго определенные т-ра и давление, изменение
любого из этих параметров приводит к исчезновению одной из фаз (см. Критические
явления).
Если k— f =
1, то v = 1, система одновариантна(мо-новариантна). В этом случае только
один параметр (напр., т-ра) м. б. изменен произвольно без изменения числа фаз,
тогда как значения других параметров (давления, концентрации в-в) полностью
определяются т-рой. При k = f и v = 2 система дивариантна.
В ней можно независимо менять (в определенных пределах) два параметра без изменения
числа фаз. Большие значения степеней свободы наблюдаются в системах с числом
компонентов 2 и более.
Ф. п. применительно к геохимии
было выведено В. M. Гольдшмидтом (1911) в след, формулировке: при произвольных
давлении и т-ре (т. е. принимая природную систему дивариантной) макс, число
сосуществующих минералов равно числу компонентов, f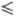 k
("минералогич. правило фаз"). Более точная формулировка принадлежит
Д. С. Коржинско-му (1942): наиб, число совместно образующихся минералов равно
числу компонентов за вычетом числа вполне подвижных компонентов (в-ва с высокой
диффузионной способностью, концентрация к-рых в р-ре практически постоянна)
и числа компонентов-примесей, к-рые вследствие малой концентрации при кристаллизации
не переходят в твердую фазу. k
("минералогич. правило фаз"). Более точная формулировка принадлежит
Д. С. Коржинско-му (1942): наиб, число совместно образующихся минералов равно
числу компонентов за вычетом числа вполне подвижных компонентов (в-ва с высокой
диффузионной способностью, концентрация к-рых в р-ре практически постоянна)
и числа компонентов-примесей, к-рые вследствие малой концентрации при кристаллизации
не переходят в твердую фазу.
Следствием Ф.п. является
правило соприкасающихся пространств состояния, к-рое связано с размерностью
R диаграммы состояния (для плоской диаграммы R= 2, для пространственной
- R = 3 и т. д.) и размерностью R' геом. элемента, по к-рому граничат
между собой области существования, или пространства состояния (для точки R'
= О, для линии R' = 1, для пов-сти R' = 2, для гиперповерхностей
R' = 3). Л. С. Палатником и А. И. Ландау было выведено (1961) правило,
связывающее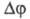 -
кол-во меняющихся (исчезающих и появляющихся) фаз в соприкасающихся пространствах
состояния с размерностями R' и R: R=R- -
кол-во меняющихся (исчезающих и появляющихся) фаз в соприкасающихся пространствах
состояния с размерностями R' и R: R=R-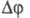 При
этом нонвариантныеравновесия, напр, трехфазные горизонтали на диаграммах состояния
двойных систем, нужно рассматривать как вырожденные пространства состояния.
Следовательно, если два разных поля (в случае плоской диаграммы) соприкасаются
по линии, то они различаются между собой на одну фазу; если поля соприкасаются
в точке, то различаются на две фазы. Два однофазных пространства ( При
этом нонвариантныеравновесия, напр, трехфазные горизонтали на диаграммах состояния
двойных систем, нужно рассматривать как вырожденные пространства состояния.
Следовательно, если два разных поля (в случае плоской диаграммы) соприкасаются
по линии, то они различаются между собой на одну фазу; если поля соприкасаются
в точке, то различаются на две фазы. Два однофазных пространства (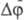 =2)
могут соприкасаться только в точке (напр., в максимуме на кривой ликвидуса фазы
переменного состава). =2)
могут соприкасаться только в точке (напр., в максимуме на кривой ликвидуса фазы
переменного состава).
Ф. п. используют в неорг.
и орг. химии, хим. технологии, галургии, металлургии, металловедении, петрографии
и т. п., при исследовании диаграмм состояния гетерогенных систем. Оно позволяет
рассчитывать возможное число фаз и степеней свободы в равновесных системах при
любом числе компонентов (исходных в-в). Особенно широко используется Ф. п. в
физико-химическом анализе.
Ф. п. было выведено Дж.У.
Гиббсом в 1876. Практич. его использование в химии для изучения и классификации
гетерогенных равновесий было начато в работах Б. Розебома (1889).
===
Исп. литература для статьи «ФАЗ ПРАВИЛО»: Палатник Л.
С., Ландау А.И., Фазовые равновесия в многокомпонентных системах, Хар., 1961;
Древинг В.П., Калашников Я.А., Правило фаз с изложением основ термодинамики,
2 изд., M., 1964; Findlay A., The phase rule and its application, N. Y., 1951;
см. также лит. к ст. Диаграмма состояния, Фазовое равновесие, Физико-химический
анализ.
П. И. Федоров.
Страница «ФАЗ ПРАВИЛО» подготовлена по материалам химической энциклопедии.
|

