|
ФЕНОЛЫ, ароматич.
соед., содержащие в молекуле одну или неск. гидроксильных групп, связанных с
атомами углерода ядра. По кол-ву ароматич. ядер различают собственно Ф., наф-толы
(2 конденсированных ядра), антролы (3 ядра), фенант-ролы (4), бензотетролы
(5), по числу гидроксильных групп в молекуле - одно-, двух-, трех- и многоатомные
Ф. Простейший Ф- гидроксибензол ф-лы C6H5OH наз. фенолом,
1,2-, 1,3- и 1,4-гидроксибензолы наз. соотв. пирокатехином, резорцином
и гидрохиноном; 1,2,3-, 1,2,4- и 1,3,5-тригидроксибен-золы - соотв.
пирогаллолом, гидроксигидрохиноном и фло-роглюцином.
Св-вами Ф. обладают также
гетероароматич. соед., содержащие гидроксильные группы, напр, гидроксипиридины.
Ф. и их производные содержатся
в древесине, торфе, буром и кам. углях, нефтяных остатках. В живой природе Ф.,
гл. обр. в виде производных, присутствуют в клетках растений (флавоноиды, таннины,
антоцианы, лигнин, меланины, гуми-новые к-ты и др.); в своб. состоянии встречаются
редко: фенол - в иглах и шишках сосны, лишайниках; пирокатехин - в чешуе лука,
плодах грейпфрута; флороглюцин -в шишках секвойи, коре яблонь и слив; гидрохинон
-в листьях и семенах груши; тимол (З-гидрокси-4-изопропил-толуол) - в листьях
тимьяна.
Ф.- бесцв. или окрашенные
кристаллы либо аморфные в-ва; часто имеют сильный характерный запах. Нек-рые
св-ва незамещенных Ф. приведены в табл.
Ф.- слабые к-ты, причем
их кислые св-ва усиливаются при введении в молекулу электроотрицат. заместителей.
Ф. хорошо раств. в этаноле, диэтиловом эфире, ацетоне, ограниченно - в бензоле,
воде. Перегоняются с водяным паром.
В ИК спектрах Ф. характеристич.
полосы поглощения валентных колебаний группы ОН (vOH) лежат
в области частот 3390-3600 см-1; при сопряжении с карбонильной группой
vOH снижается на 350-500 см-1. В УФ спектрах области
поглощения 210 (e 6200) и 270 (e 1450) нм.
СВОЙСТВА НЕКОТОРЫХ ФЕНОЛОВ
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Р-римость в воде,
% по массе
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2,2-бис-(4-Гид-роксифенил)-пропан
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Ф. вступают в р-ции как
по гидроксильной группе, так и по ароматич. кольцу. Легко раств. в р-рах щелочей
MOH с образованием солей - фенолятов ф-лы ArOM; исключение составляют т. наз.
пространственно-затрудненные алкилфено-лы. Как и спирты, Ф. образуют
эфиры: простые - с алкилга-логенидами или диалкилсульфатами и сложные - с хлоран-гидридами
к-т; мн. эфиры обладают приятным запахом и используются в парфюмерии, напр,
анизол. Замена группы ОН на NH2 происходит при действии на
Ф. при повышенной т-ре NH3 и солей аммония, а также NH3
в водных р-рах гидросульфитов щелочных металлов (р-ции Бухерера).
Замещение гидроксила на
водород в Ф. происходит под действием LiAlH4, а также при гидрировании
при 325-400 0C и повышенном давлении в присуг. Al-, Со- и Мо-катализато-ров.
Гидрирование при т-рах 150-250 0C в присут. Ni- и Pd-катализаторов
в жидкой фазе приводит гл. обр. к алицик-лич. спиртам.
С наличием в молекуле Ф.
группы ОН - сильного ор-то-пара-ориентанта - связана легкость
электроф. замещения атомов H ядра при галогенировании, нитровании, суль-фировании
и алкилировании. Галогенирование Ф. осуществляют как действием своб. галогенов
(за исключением F2), так и с использованием др. реагентов (напр.,
CuCl2 в ДМФА или CHCl3, трет-бутилгипохлорита,
N-бромсукцинимида). Фторфенолы обычно получают из диазониевых солей гидро-ксиаренов
обработкой фтороборной к-той с послед, термич. разложением образовавшегося продукта
(Шимана реакция). В пром-сти монохлорфенолы получают хлорированием Ф.
Cl2 или SOCl2, ди-, три- и пентахлорзамещенные - прямым
хлорированием в присут. AlCl3, FeCl3 или SbCl5
(см. Хлор-фенолы).
Нитрование Ф. разб. HNO3
идет с образованием смеси орто- и пара-мононитропроизводных; катализатор
р-ции -нитрит щелочного металла. Другие нитрующие агенты - аце-тилнитрат, N2O4
и его комплекс с BF3. Нитрование Ф. конц. HNO3 или нитрующей
смесью приводит обычно к смеси ди-и тринитропроизводных (см. Нитрофенолы).
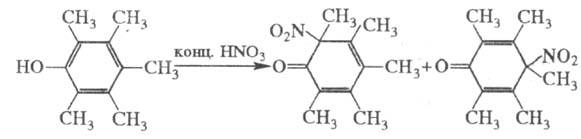
Полиалкил- или полигалогенфенолы в аналогичных условиях часто превращаются
в смесь нитроциклогексадиенонов, напр.:
Сульфирование Ф. H2SO4
при низкой т-ре протекает с образованием орто- и пара-сульфопроизводных,
сульфирова-ние олеумом при повышенной т-ре - с образованием смеси ди- и трисульфопроизводных
(см. Нафтолсулъфокислоты, Фенолсулъфокислоты). Ф. легко алкилируются
алкилгалоге-нидами, спиртами или олефинами по Фриделя - Крафтса реакции в
присут. к-т Льюиса (AlCl3, ZnCl2, BF3, SnCl4);
при алкилировании олефинами в качестве катализатора часто используют конц. H2SO4
и катионообменные смолы. Др. катализаторы алкилирования Ф.- оксиды металлов
(напр., Al2O3), металлы (Cu, Zn, Cr, Fe, Pb, Mo, W, Al),
иногда -алифатич. эфиры бензолсульфокислот.
При действии CO2
на феноляты происходит карбокси-лирование Ф. по Кольбе - Шмитта реакции с
образованием ароматич. гидроксикислот. Формилирование осуществляют действием
на Ф. в щелочной среде CHHal3 по Рай-мера - Тимана реакции; продукты
р-ции - ароматич. орто-гидроксиальдегиды. Многоатомные Ф. или их эфиры обычно
ацилируют действием нитрилов или HCN в присут. HCl и катализатора (ZnCl2,
FeCl3, CoCl2, AlCl3 и др.) по Хеша реакции.
Ф. легко конденсируются
с карбонильными соед. в присут. кислотных или основных катализаторов, напр.:

Конденсация Ф. с альдегидами
приводит к феноло-альдегид-ньш смолам (см. также Резольные смолы,
Резорцино-алъде-гидные смолы, Феноло-формалъдегидные смолы).
Окисление Ф. окислителями
может осуществляться по разл. механизмам с образованием разнообразных соединений.
Окисление Ф. в бескислородной среде под действием K3[Fe(CN)6],
PbO2, Ag2O и др. приводит к образованию ароксилъныхрадикалов,
стабильность к-рых зависит от кол-ва и строения алкильных заместителей в
ароматич. ядре. Одноатомные Ф. под действием O2 воздуха или K2S2O8
(по Эльбса реакции)превращаются в двухатомные, к-рые в свою очередь
под действием I2, Ag2O и др. легко превращаются в орто-
и пара-хиноны. При этом первой стадией окисления является образование
орто- или пара-семихинонных радикалов (см. Сем ихиноны).
В биол. объектах Ф. участвуют
в окислит.-восстановит. р-циях обмена в-в, включая фотосинтез у растений. Являются
регуляторами процессов жизнедеятельности, оказывая как ингибирующее, так и стимулирующее
действие.
Ф. выделяют из продуктов
переработки твердых топлив или из растит, сырья. Существуют также многочисленные
пром. синтетич. методы получения Ф.: окисление ароматич. углеводородов и циклоалканов,
гидролиз арилгалогенидов, щелочное плавление ароматич. сульфокислот. Лаб. способы
получения - гидролиз ароматич. аминов и простых алкиларило-вых эфиров, а также
из солей диазония.
Для качеств, определения
Ф. используют цветные р-ции с солями тяжелых металлов, напр, с FeCl3
фенол, резорцин и a-нафтол дают интенсивное фиолетовое окрашивание: кре-золы,
2,4-ксиленол, гидрохинон - синее, b-нафтол и пирокатехин - зеленое. В качестве
реагентов для обнаружения Ф. используют диазосоединения, 4-аминоантипирин, NaNO2,
MO-либдат и ванадат аммония.
Ф. применяют в произ-ве
разл. феноло-альдегидных смол, полиамидов, полиарилатов, полиариленсульфонов,
эпоксидных смол, антиоксидантов, бактерицидов и пестицидов (напр., нитрафен).
Алкилфенолы используют в произ-ве ПАВ, стабилизаторов и присадок к топливам.
Двухатомные Ф. и их производные
входят в состав дубителей для кожи и меха, модификаторов и стабилизаторов резин
и каучуков, применяются для обработки кино- и фотоматериалов. В медицине Ф.
и их производные используют в качестве антимикробных (фенол, резорцин), противовоспалительных
(салол, осарсол), спазмолитических (адреналин, папаверин), жаропонижающих (аспирин,
салициловая к-та), слабительных (фенолфталеин), адренолити-ческих (мезатон),
вяжущих (таннины) и др. лек. ср-в, а также витаминов E и P.
Мировой объем произ-ва
Ф. ок. 5 млн. т в год (1985), в наиб, кол-вах производят фенол, двухатомные
фенолы, наф-толы, бисфенол А.
===
Исп. литература для статьи «ФЕНОЛЫ»: Б ю л е r
К., Пирсон Д., Органические синтезы, пер. с англ., ч. 1, M., 1973, с. 281-324;
Харлампович Г.Д., Чуркин Ю.В., Фенолы, M., 1974; Общая органическая химия, пер.
с англ., т. 2, M., 1982, с. 175-289; Kiik-Othmer encyclopedia, 3 ed., v.
17, N. Y., 1984, p. 373-83.
/f. Д. Синович, Г. П.
Павлов.
Страница «ФЕНОЛЫ» подготовлена по материалам химической энциклопедии.
|

