|
ФОСФАТЫ ОРГАНИЧЕСКИЕ,
эфиры фосфорной к-ты общей ф-лы (RО)nР(О)(ОН)3_n,
где R - орг. радикал, n = 1-3. Различают полные (n = 3; средние,
или третичные Ф. о.) и кислые Ф.о. (n = 1,2, соотв. первичные и вторичные
Ф.о.).
Назв. Ф. о. включает назв.
орг. радикала (радикалов) в алкоксильной группе, к-рые являются префиксами к
слову "фосфат", иногда Ф. о. наз. как эфир фосфорной к-ты [напр.,
C2H5OP(O)(OH)2 - этилфосфат, или этиловый эфир
фосфорной к-ты]; кислые Ф. о. наз. также органил- и диорганилфос-форными к-тами
[напр., (C2H5O)2P(O)OH - диэтилфосфор-ная к-та].
Кислые Ф. о., в к-рых R
- остаток глицерина, углевода, аминоспиртов и др. (напр., аденозинмонофосфат
циклический,
нуклеиновые кислоты, нуклеотиды, тейхоевые кислоты, фосфолипиды), распространены
во всех живых организмах и имеют важное значение для их жизнедеятельности.
Физ.-хим. свойства.
Как правило, Ф. о. с низшими алифа-тич. радикалами - подвижные (n
= 3) или вязкие (n =1,2) жидкости, остальные - кристаллич. в-ва или масла
(табл.). Большинство кислых и полных Ф. о. с низшими алифатич. радикалами раств.
в воде; многие Ф. о. раств. в спиртах, CHCl3 и др. полярных орг.
р-рителях; третичные и вторичные Ф. о. с R = Alk, Ar раств. также в простых
эфирах, бензоле, галогенуглеводородах.
СВОЙСТВА ОРГАНИЧЕСКИХ
ФОСФАТОВ
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Хим. сдвиг в спектре
ЯМР3IР,
м.д.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
* d2020
Кислые Ф. о. (их соли также
наз. фосфатами) - более сильные к-ты, чем H3PO4 [напр.,
рКа для CH3OP(O)(OH)2 1,54 и 6,31, для
глюкозо-6-фосфата 0,94 и 6,11, для (CH3O)2P(O)(OH) 1,29].
Диалкилфосфаты в р-ре обычно ди-мерны, моноалкилфосфаты в гексане, бензоле и
CCl4 - оли-гомеры (степень олигомеризации 8-14), в метаноле - мономеры.
Конфигурация молекул -
тетраэдрическая с атомом P в центре. Величины дипольных моментов Ф. о. колеблются
в пределах 7,6· 10-30- 1,067· 10-29 Кл·м. В ИК спектрах
полосы поглощения связи P = O 1200-1320, P-OH 820-1030, P-OC 1087-1242, C-OP
ок. 1030, О —H 2525-3000 и 2000-2400 см -1. В спектрах ЯМР 31P
хим. сдвиги от -23 до +28 м. д.; константы спин-спинового взаимод. атомов Р-0-Нб-11
Гц.
Хим. свойства. Триарилфосфаты
обычно устойчивы до 300-350 0C; алкил- и арил(алкил)фосфаты разлагаются
при т-ре выше 150 0C (разложение полных фосфатов катализируют кислые
примеси). При термич. разложении алкилфосфа-тов обычно образуются олефины:

Соед. с линейными цепями
более устойчивы, чем с разветвленными; однако, если у атома С в 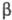 -положении
отсутствует хотя бы один атом водорода,- термич. стабильность существенно повышается.
Термич. разложение -положении
отсутствует хотя бы один атом водорода,- термич. стабильность существенно повышается.
Термич. разложение  -хлоралкилфосфа-тов
протекает без выделения олефина по схеме: -хлоралкилфосфа-тов
протекает без выделения олефина по схеме:
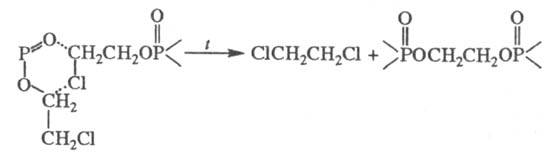
При нагр. и длит. хранении
кислые фосфаты частично диспропорционируют, напр.:
2(RO)2P(O)OH (RO)3PO + ROP(O)(OH)2
(RO)3PO + ROP(O)(OH)2
Алкилфосфаты достаточно
сильные алкилирующие агенты; такая способность возрастает у них с уменьшением
объема алкильного радикала. В сравнительно мягких условиях они алкилируют амины,
соли галогеноводородных к-т, алкоголяты; при нагр.- спирты и ароматич. соед.,
напр.:
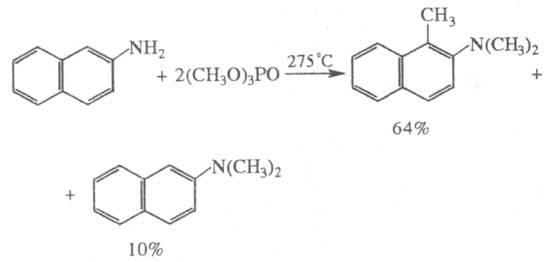
Алкил- и арилфосфаты обычно
устойчивы к гидролизу при комнатной т-ре и рН ок. 7. Исключительно высокой гидро-литич.
и термич. устойчивостью обладают бициклофосфаты (ф-ла I). Гидролиз кислых фосфатов
обычно ускоряется в
кислых, а полных - в щелочных
средах. В зависимости от условий гидролиза и структуры Ф. о. может происходить
разрыв связи P — О (напр., при гидролизе первичных
и третичных алкил-фосфатов при рН 10), С — О (в любых условиях в диалкил-фосфатах)
или тех и др. связей. Циклич. фосфаты (II; X = OR, ОН) гидролизуются в 106-108
раз быстрее, чем (AIkO)2P(O)X или их б- и 7-членные циклич. аналоги.
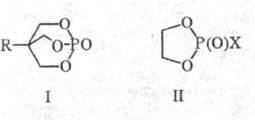
С очень высокими скоростями
и экзотермически гидролизуются
нек-рые биологически важные высокоэнергетич. фос-фаты [напр., 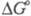 , кДж/моль, при рН 7 для HOOСС(СН3)2ОР(О)(ОН)2
- 62,01; для CH3C(O)OP(O)(OH)2-
41,9; для (HO)2P(O)OCH2CH(OH)C(O)OP(O)(OH)2
-49,44; см. также
Аденозинфосфорные кислоты].
, кДж/моль, при рН 7 для HOOСС(СН3)2ОР(О)(ОН)2
- 62,01; для CH3C(O)OP(O)(OH)2-
41,9; для (HO)2P(O)OCH2CH(OH)C(O)OP(O)(OH)2
-49,44; см. также
Аденозинфосфорные кислоты].
Алкил- и арилфосфаты подвергаются
алкоголизу лишь в жестких условиях. Исключение составляют соед., у к-рых R =
алкенил, ацил, CH2CH2F, C(CCl3) = NH, C(NRH)=NR,
используемые в синтезе прир. соединений. Нек-рые из этих соед., а также арилфосфаты
вступают в р-цию аминолиза.
Благодаря электронодонорным
св-вам Ф. о. дают устойчивые аддукты с BX3 (X = Hal, OR), образуют
комплексы с нек-рыми ионами тяжелых металлов (U, Pu, Np, Zr, Th, Ce и др.).
Нек-рые металлы II гр. периодич. системы способны внедряться по связи С — О
полных фосфатов, напр.:
(CH3O)3PO
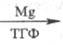 (CH3O)2P(O)OMgCH3 (CH3O)2P(O)OMgCH3
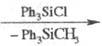
 (CH3O)2P(O)OMgCl (CH3O)2P(O)OMgCl
В полных фосфатах группы
RO м. б. замещены на Hal(Cl, F) действием RC(O)Hal или PHal5, а также
на орг. радикалы действием R'MgHal. При нагр. с P2S5 полные
Ф. о. превращаются в тионные аналоги [в ходе р-ции они частично изоме-ризуются
в тиолфосфаты (RO)2P(O)SR]. Взаимод. полных Ф. о. с P2O5
м. б. получены пиро- или метафосфаты:
4(RO)3PO + P2O5 3(RO)2P(O)OP(O)(OR)2 n(RO)3PO + nP2O5
3(RO)2P(O)OP(O)(OR)2 n(RO)3PO + nP2O5 (ROP02)n
(ROP02)n
Получение Ф. о. Общий
метод синтеза Ф. о. в пром-сти основан на р-ции POCl3 со спиртами
или фенолами (в присут. акцепторов HCl или с его отдувом) либо с их Na- или
К-производными. Атомы Cl в POCl3 можно последовательно замещать на
разл. группы RO. Образующиеся первоначально хлорфосфаты путем гидролиза можно
превращать в кислые Ф. о., а действием эпоксидов - в 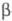 -хлоралкилфосфаты. -хлоралкилфосфаты.
Кислые Ф. о. получают также
алкоголизом P2O5. В зависимости от соотношения реагентов
и др. условий образуются преим. первичные или вторичные фосфаты, либо эквимоляр-ная
смесь этих соединений.
Пром. значение имеют также
след, методы синтеза Ф. о.: взаимод. PCl3 или белого P со спиртами
и хлором; получение (C2H5O)3PO р-ций P2O5
с диэтиловым эфиром в атмосфере этилена при 180 0C; действие ROH
на диалкилфосфиты в среде CCl4 в присут. третичных аминов (см. Тодда-Атертона
реакция). Винилфосфаты получают взаимод. (RO)3P с a-гало-генкарбонильными
соед. (см. Перкова реакция)или взаимод. хлорфосфатов с карбонильными
соед. типа О = CXCHR2 (X = H, Alk, OR, SR, CN и др.; R = H, Alk,
Hal и др.) в присуг. оснований.
Для получения нуклеотидов,
фосфатов Сахаров, фосфоли-пидов и др. биологически важных Ф. о. обычно используют
активир. фосфорилирующие агенты. За редким исключением (напр., морфолидо-, имиддазолидо-
и триазолидопроизвод-ных) такие соед. получают и применяют без выделения, напр.:
Ограниченное использование
в синтезе Ф. о. имеют такие методы, как окисление эфиров фосфористой к-ты (с
помощью N2O4, H2O2 и др.), алкилирование
солей кислых фосфатов с помощью RHal, алкоголиз или гидролиз ангидридов фосфорной
к-ты, взаимод. алкоксисиланов с галогенида-ми 4-координац. P.
Применение. Ф. о.
широко используют в качестве добавок для модификации пластмасс (как пластификаторы,
для повышения огнестойкости и способности к прокрашиванию -трибутилфосфат,
трифенилфосфат, трикрезилфосфат, 2-этилгексилфосфаты и др.), экстрагентов
(напр., трибутилфосфат и 2-этилгексилфосфаты - для экстракции U, Pu, Np и др.
радиоактивных элементов из отработанного ядерного горючего и РЗЭ из минер, сырья),
флотореагентов, теплоносителей, пестицидов, лек. ср-в и др.
===
Исп. литература для статьи «ФОСФАТЫ ОРГАНИЧЕСКИЕ»: КорбриджД.,
Фосфор, пер. с англ., M., 1982, с. 329-429; Общая органическая химия, пер. с
англ., т. 5, M., 1983, с. 44-95; Cherbuliez E., в кн.: Organic phosphorus compounds,
eds. G. Kosolapoff, L. Maier, v. 6, N. Y., 1973, p. 211-577; Clark V. [u.
a.], "Angew. Chem.", 1964, Bd 97, № 3, S. 678.
Г. И. Дрозд.
Страница «ФОСФАТЫ ОРГАНИЧЕСКИЕ» подготовлена по материалам химической энциклопедии.
|

