|
ФОСФИДЫ, соединения
фосфора с более электроположит. элементами. По типу хим. связи Ф. подразделяют
на соед. с преим. ионной связью, металлоподобные и с преим. ковален-тной связью.
К ионным относятся Ф. щелочных и щел.-зем. элементов и металлов подгруппы цинка.
Эти Ф. легко гидролизуются водой, хорошо раств. в к-тах с выделением PH3,
сгорают в токе O2 с образованием оксидов металлов и P, реагируют
с галогенами. Нек-рые из них обладают полупроводниковыми св-вами из-за того,
что в межатомной связи присутствует определенная доля ковалентной составляющей.
Металлоподобные Ф. образуют гл. обр. переходные металлы, в т. ч. РЗЭ. Их состав,
как правило, не соответствует валентностям образующих их элементов. Эти Ф. тугоплавки,
устойчивы к действию воды и K-T. Их хим. стойкость растет с увеличением содержания
P. Так, Ni3P, Cr3P, Fe3P, Ti3P легко
разлагаются к-тами-окислителями (H2SO4, HNO3,
HClO4), а также щелочами. В то же время Ф. состава TiP, VP, TaP,
CrP, FeP, MnP не взаимод. с конц. соляной к-той и к-тами-окислителями. Они раств.
при нагр. в царской водке. Все металлоподобные Ф. разлагаются смесью HF и HNO3
и при сплав-лении с щелочами и пероксидами металлов. Многие из них -полупроводники
благодаря тому, что в хим. связь вносит определенный вклад ковалентная составляющая.
Ковалеитные Ф. образуются
непереходными элементами III и IV гр. периодич. системы (кроме Tl). Они тугоплавки,
их хим. стойкость к воде и др. агрессивным средам сильно зависит от чистоты
образца. Особенно устойчивы высоко чистые в-ва. Все твердые ковалентные Ф.-
полупроводники, ширина запрещенной зоны к-рых тем больше, чем выше доля ионной
связи в них. Типичные полупроводниковые Ф. этой группы представляют собой координац.
соед., в к-рых помимо простых ковалентных связей присутствуют донор-но-акцепторные
связи. При этом атом P - донор, а атомы более электроположит. элемента - акцепторы
электронной пары.
Ф. полуметаллов и неметаллов
также гл. обр. ковалентные соед. Они м. б. газами (напр., PH3), твердыми
в-вами; по электрофиз. св-вам - диэлектриками или полупроводниками. Типичный
диэлектрик - BP. Он устойчив к действию к-т-окислителей и щелочей. Другие Ф.
этой группы, напр. AlP и SiP, не обладают большой стойкостью к действию хим.
реагентов.
Св-ва нек-рых Ф. представлены
в табл. Ф. активных металлов - солеобразные в-ва, Ф. металлов подгруппы Zn,
у к-рых полностью заполнены (п — 1)d-орбитали,- полупроводники.
В случае переходных металлов с незаполненными полностью (п— 1)d-орбиталями
Ф. могут быть как полупроводниками, так и металлоподобными. Для последних характерно
относительно меньшее содержание P в формульной единице. При этом ферромагн.
металлы могут образовывать и ферромагн. Ф., напр. Fe3P и CoP. Типичные
полупроводники - Ф. элементов групп Ша и IVa (GaP, InP, SiP, GeP).
|
|
|
|
|
|
|
|
|
|
СВОЙСТВА НЕКОТОРЫХ
ФОСФИДОВ
|
|
|
|
|
|
|
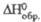
кДж/моль
|
Ширина запрещенной
зоны, эВ
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
а Солеобразен.
б Полупроводник. в Металлоподобен.г
Диэлектрик. д Ферромагнетик. е С разложением.
Осн. метод получения Ф.-
синтез из простых в-в в вакууме, атмосфере инертного газа или под давлением
паров P. Можно также получать Ф. взаимод. PH3 с металлами или их
оксидами, карботермич. восстановлением фосфатов, обменной фосфи-дизацией (р-ция
металла или его хлорида с др. Ф.) и т. д. Наиб. практич. применение нашли галлия
фосфид и индия фосфид как полупроводниковые и оптоэлектронные материалы.
SiP используют для легирования монокристаллов Si. Перспективные полупроводниковые
материалы - тройные Ф., напр. ZnSiP2, CdGeP2. Соед. Cu3P
применяют как раскислитель в произ-ве бронз, для пайки латуни вместо серебряного
припоя.
Zn3P2
и Cu3P - полупроводниковые материалы, Zn3P2
- также зооцид. Ф. железа и Ni употребляют для создания износостойких покрытий
на деталях машин. Благодаря самопроизвольному выделению горючих фосфинов во
влажном воздухе Mg3P2 и Ca3P2 являются
компонентами спец. сигнальных устройств и пиротехн. составов. Ф.
токсичны из-за выделения PH3.
ПДК для Cu3P
0,5 мг/м3, для Zn3P2 0,1 мг/м3.
===
Исп. литература для статьи «ФОСФИДЫ»: Самсонов Г.В.,
Верейкина Л.Л., Фосфиды, К., 1961; Кри-сталлохимические, физико-химические и
физические свойства полупроводниковых веществ. Справочник, M., 1973; Угай Я.
А., Введение в химию полупроводников, 2 изд., M., 1975; Гончаров E. Г., Полупроводниковые
фосфиды и арсениды кремния и германия, Воронеж, 1989. Я. А. Угай.
Страница «ФОСФИДЫ» подготовлена по материалам химической энциклопедии.
|

