|
ФОСФОЛИПАЗЫ (фосфатидазы),
ферменты класса гидро-лаз, катализирующие гидролиз фосфоглицеридов. В
зависимости от места действия на субстрат (позиционной специфичности) различают
фосфолипазы A1, A2, С и D (хим. связи, к-рые
гидролизуют эти Ф., показаны на ф-ле I); лизофосфолипиды расщепляются
под действием Ф. L (ф-ла II; существование позиционно специфичных Ф.
L1 и L2 не доказано). Ф. В - устаревшее
назв. препаратов, обладающих активностью по типу Ф. А и L.
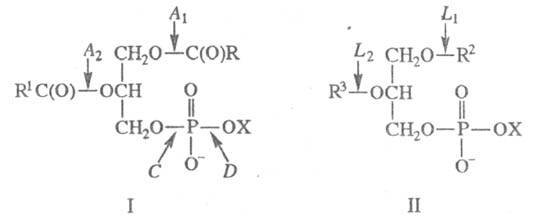
X - остаток холина, серина,
мио-инозита и др.; для Ф. L1 R2=C(O)R4,
R3=H; для Ф. L2 R2=H, R3=C(O)R4
Каждое из семейств Ф. неоднородно
и включает ферменты, значительно отличающиеся по мол. массам, субъединичному
составу и др. св-вам. Все Ф. наиб. активно катализируют гидролиз на пов-сти
раздела фаз фосфолипид - вода; медленно гидролизуют водорастворимые субстраты.
Ф. A1 в большинстве
своем - внутриклеточные ферменты, часто мембраносвязанные, не нуждаются в коферменте.
Их мол. массы варьируют в пределах 15-90 тыс.; оптимальная каталитич. активность
проявляется при рН 4,0 (для лизосо-мальных ферментов) или 8,0-9,5 (для ферментов
микросом, плазматич. мембран и цитозоля); широко распространены в животных тканях
(печень, сердце, мозг) и в микроорганизмах (Bacillus subtilis, В. megateiium,
Mycobacter phlei, Escherichia coli).
Ф. A2 - наиб,
изученные представители Ф. Известны 3 группы Ф. A2: 1) ферменты ядов
змей, рептилий и насекомых, существующие в виде большого кол-ва изоформ (см.
Изофер-менты) 2) ферменты поджелудочной железы млекопитающих,
продуцирующиеся в организме в виде зимогенов (предшественников с большей мол.
массой) и активирующиеся трипсином; 3) внутриклеточные ферменты из крови и тканей
животных, среди к-рых имеются как р-римые, так и мембра-носвязанные. Ф. A2
первых двух подгрупп являются водорастворимыми ферментами с мол. м. 11-19
тыс. (нек-рые активны в виде димеров), обладают высокой стабильностью благодаря
большому числу (6-7) дисульфидных связей; оптимальная каталитич. активность
при рН 7,5-9,0; рI от 4,0 до 10,5; кофермент - Ca2+. Для мн.
представителей этих подгрупп Ф. известны первичная и пространственная структура;
в активном центре обнаружены остатки гистидина и аспара-гиновой к-ты. Cв-ва
внутриклеточных Ф. A2 (третья подгруппа) зависят от субклеточной
локализации фермента. Их мол. м. 12-75 тыс.; оптимальная каталитич. активность
при рН 4,2-9,0; нек-рые ферменты этой подгруппы не содержат коферментов.
Ф. L выделены из растений,
микроорганизмов, яда пчел, тканей млекопитающих. Ферменты этой группы крайне
неспецифичны, катализируют гидролиз разл. сложноэфирных связей, обладают литическим
(разрушающим) действием по отношению к биол. мембранам (что обусловливает их
токсичность). Мол. м. Ф. L 15-65 тыс., они менее стабильны, чем Ф. А;
их оптимальная каталитич. активность проявляется при рН от 4,5 (лизосомальный
фермент) до 10,0 (ферменты ядов); Ф. L не имеют коферментов, не ингибируются
этилендиамин-тетрауксусной к-той; нек-рые Ф. L ингибируются диизопро-пилфторфосфатом
и п-хлормеркурбензойной к-той; универсальные ингибиторы для всех Ф. L - ПАВ.
Ф. С обнаружены
у бактерий Clostridium, Bacillus и Pseudo-monas, а также в клетках млекопитающих
(печень, мозг, поджелудочная железа). Для нек-рых из них характерна строгая
специфичность по отношению к спиртовой группе молекулы субстрата, напр. к остатку
холина (Ф. Cx) и мио-инозита (Ф. Си). Мол. м. Ф.
С от 23 до 51 тыс., ионы Zn2+ являются для них коферментом и стабилизатором;
оптимальная каталитич. активность при рН ок. 7 для Ф. Cx и при рН
< 7 для Ф. Си.
Ф. D обнаружены
в растениях (овощи, водоросли), микроорганизмах и в тканях животных. Их мол.
м. 90-116 тыс.; оптимальная каталитич. активность при рН 4,7-8,0. Катион-ные
ПАВ ингибируют Ф. D, анионные - активируют.
Помимо гидролитич. ф-ции
Ф. обладают трансацилазной (Ф. A1, A2 и L) и транс
фосфатидилазной (Ф. Си D) активностью.
Ф. играют важную роль в
обмене липидов в живых организмах. Их используют для определения структуры фосфо-глицеридов
и места их локализации в мембранах.
===
Исп. литература для статьи «ФОСФОЛИПАЗЫ»: Брокерхоф
X., Дженсен Р., Липолитические ферменты,пер. с англ., M., 1978, с. 242-356;
Van den Bosch H., "Biochim. et Biophys. Acta", 1980, v. 604,
№ 2, p. 191-246; Dennis E. А., в кн.: The enzymes, 3 ed., v. 16, N. Y.- L.,
1983, p. 307-53. T. В. Романова.
Страница «ФОСФОЛИПАЗЫ» подготовлена по материалам химической энциклопедии.
|

