|
ФОСФОРА ОКСИДЫ. В
качестве индивидуальных B-B установлены: P4O, P4O2
(P2O), P4O6 (P2O3), P4O8,
P4O10 (P2O5), PO3; молекулы
изображенных в скобках Ф. о. существуют в виде димеров. Теоретически показана
вероятность существования (при окислении паров P) метастабильных Ф. о. ряда
P4On, где n = 6-9, и продуктов их диссоциации
- PO, PO2. Молекула PO обнаруживается лишь спектроскопически в парах.
Наиб. изучены P4O6 и P4O10. Нек-рые
св-ва Ф. о. представлены в таблице.
Монооксид тетрафосфора
P4O- красно-бурые кристаллы; плотн. 1,891 г/см3; при 270-280
0C воспламеняется; в сухом воздухе устойчив до 350 0C,
при нагр. в инертном газе разлагается с выделением P и P4O10;
с водой не реагирует, во влажном состоянии разлагается на воздухе выше 100 0C.
Образуется P4O при сжигании P в недостатке кислорода, при взаимод.
POCl3 с Al, Zn (100 0C) или белым фосфором (250 0C),
а также при длит. выдержке на воздухе р-ра P в PCl3 и диэтиловом
эфире.
СВОЙСТВА ОКСИДОВ ФОСФОРА
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
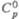 , Дж/(моль·К)
, Дж/(моль·К)
|
|
|
|
|
|
|
|
|
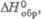 кДж/моль
кДж/моль
|
|
|
|
|
|
|
|
|
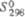 ,Дж/(моль·К)
,Дж/(моль·К)
|
|
|
|
|
|
|
|
|
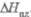 , кДж/моль
, кДж/моль
|
|
|
|
|
|
|
|
|
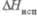 , кДж/моль
, кДж/моль
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
a Дм
газа, для твердого P4O6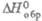 -1668 кДж/моль. б Т-ра возгонки.
-1668 кДж/моль. б Т-ра возгонки.
Диоксид тетрафосфора P4O2
(P2O) - желто-красные кристаллы; при нормальном давлении устойчив
до 100 0C, в вакууме - до 135 0C, при более высоких т-рах
разлагается с выделением P; с водой не реагирует, в запаянной трубке в среде
воздуха водный р-р P4O2 окисляется до H3PO3;
устойчив в сухом воздухе, не раств. в этаноле, ацетоне и др. Получают P4O2
продуванием O2 или воздуха через р-р белого P в CCl4 при
50-60 С, а также нагреванием POCl3 и H4PBr2 до
773 0C в запаянной трубке. P4O2 восстанавливает
Fe3+, Cu2+, Ag+; это св-во P4O2
используют для восстановления примесей Fe в экстракционной H3PO4.
Гексаоксид тетрафосфора
(устар. назв.- фосфористый ангидрид) P4O6 - белые хлопья
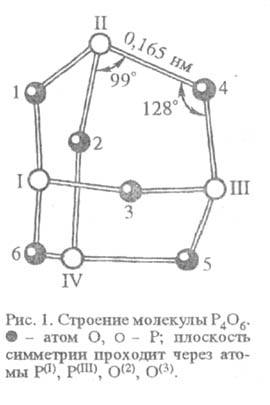
или кристаллы с неприятным запахом. Структура молекулы твердого P4O6
показана на рис. 1; давление пара 9,34 кПа (343 К); более устойчив, чем
P4O и P4O2, выше 200 0C разлагается
с частичным отщеплением элементного (красного) P и разл. оксидов (P4O8,
P4O10); вблизи точки затвердевания кристаллизуется. Хорошо
раств. в орг. р-рителях (бензоле, CS2), что используют для очистки
P4O6 перекристаллизацией. В 100 г P4O6
раств. до 1,7 г P, к-рый м. б. извлечен путем перевода в красный P при
УФ облучении с послед. растворением оксида в CS2.
В обычных условиях P4O6
медленно окисляется до P4O10. В атмосфере сухого разреженного
O2 он окисляется при 40 0C, во влажном O2
- при 130 0C, сухой P4O6 устойчив в сухом O2
до 77-127 0C, в воздухе - до 450 0C. При сильном нагревании
в отсутствие воздуха разлагается на P и P2O4. При растворении
в холодной воде образует H3PO3, в горячей - H3PO4,
PH3 и P. С HCl дает H3PO3 и PCl3,
энергично реагирует с Cl2, Br2, I2 и S выше
150 0C. Образуется P4O6 при сжигании P с ограниченным
доступом сухого воздуха. P4O6 ядовит.
Октаоксид тетрафосфора
P4O8— белые хлопья или кристаллы. Молекула оксида в газообразном
состоянии соответствует ф-ле P8O16. В кристалле она имеет
сложную структуру и включает агрегаты от мономера до тримера (P4O8,
P8O16, P12O24). Известны две кристаллич.
формы P4O8. Ром-боэдрич. a-форма содержит молекулы
P4O8 и P4O9 в разл. соотношениях
и имеет средний состав в пределах P4O8,1-Р4О9,0.
Моноклинная b-форма состоит из молекул P4O7 и P4O8;
ее состав: P4O7,7-P4O8,0. Имеются
данные о существовании аморфной формы P4O8.
Октаоксид устойчив при
нагр. до 100 0C, возгоняется при 180 0C; окисляется до
P4O10 в среде чистого O2 выше 400 С. Кристаллич.
P4O8 расплывается на воздухе, хорошо раств. в воде, но
не раств. в орг. р-рителях. При растворении в воде дает равное кол-во молей
H3PO3 и HPO3. Водные р-ры P4O8
с трудом окисляются до H3PO4. Оксид P4O8
образуется при низкотемпературном сжигании P в ограниченном кол-ве воздуха или
при нагр. P4O6 в течение 48 ч в запаянной трубке при 200-250
0C,
Декаоксид тетрафосфораP4O10
(или P2O5, пента-оксид; устар. назв.- фосфорный ангидрид)
- бесцв. аморфное, стекловидное (G-форма) или кристаллич. в-во. Существуют
две метастабильные кристаллич. модификации:гексагон. Н-форма (а
= 0,744 нм, 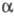 =
87°, пространств, гр. R3С)и ор-торомбич. О-форма (а
= 0,923 нм, b - 0,718 нм, с = 0,494 нм, пространств, гр. Рпат)
одна стабильная - орторомбич. О -форма (а =1,63 нм, b=
0,814 нм, с =0,526 нм, пространств. гр. Fdd2 по нек-рым данным,
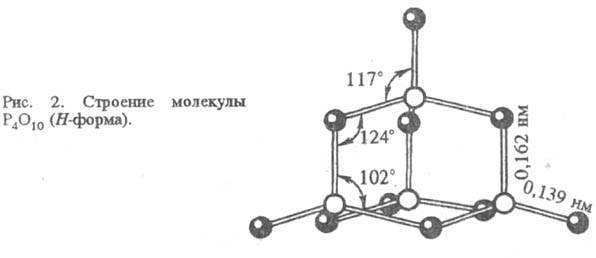
тетрагон. T-форма). Структура молекулы P4O10 H-формы
построена из 4 групп PO4 в виде тетраэдра, вершины к-рого занимают
атомы P; 6 атомов О располагаются вдоль ребер, а 4 - по оси третьего порядка
тетраэдра (рис. 2). Другие модификации имеют слоистую полимерную структуру,
также построенную из тетраэдров PO4, к-рые объединены в кольца -
10-членные в случае О-формы и 6-членные в случае О'-формы (рис.
3). H-форма переходит в О-форму при 300-360 0C (переход
заканчивается при 378 0C), а также при нагр. (127 0C)
в течение 2 ч в запаянной ампуле. При нагр. О-формы в запаянной трубке
(при 450 0C) в течение 24 ч образуется более устойчивая О'-форма.
При плавлении H-формы получается, по-видимому, мономолекулярная жидкость,
при плавлении О- и O'-моди-фикаций - полимерная форма жидкого
P4O10. Тройные точки: для H-формы 420,5 0C,
давление 478,8 кПа; для О-формы 562,5 0C, 58,0 кПа; для О'-формы
580,5 0C, 73,82 кПа. =
87°, пространств, гр. R3С)и ор-торомбич. О-форма (а
= 0,923 нм, b - 0,718 нм, с = 0,494 нм, пространств, гр. Рпат)
одна стабильная - орторомбич. О -форма (а =1,63 нм, b=
0,814 нм, с =0,526 нм, пространств. гр. Fdd2 по нек-рым данным,
тетрагон. T-форма). Структура молекулы P4O10 H-формы
построена из 4 групп PO4 в виде тетраэдра, вершины к-рого занимают
атомы P; 6 атомов О располагаются вдоль ребер, а 4 - по оси третьего порядка
тетраэдра (рис. 2). Другие модификации имеют слоистую полимерную структуру,
также построенную из тетраэдров PO4, к-рые объединены в кольца -
10-членные в случае О-формы и 6-членные в случае О'-формы (рис.
3). H-форма переходит в О-форму при 300-360 0C (переход
заканчивается при 378 0C), а также при нагр. (127 0C)
в течение 2 ч в запаянной ампуле. При нагр. О-формы в запаянной трубке
(при 450 0C) в течение 24 ч образуется более устойчивая О'-форма.
При плавлении H-формы получается, по-видимому, мономолекулярная жидкость,
при плавлении О- и O'-моди-фикаций - полимерная форма жидкого
P4O10. Тройные точки: для H-формы 420,5 0C,
давление 478,8 кПа; для О-формы 562,5 0C, 58,0 кПа; для О'-формы
580,5 0C, 73,82 кПа.
P4O10
очень гигроскопичен (H-форма поглощает воду даже со взрывом), что делает
его одним из наиб. эффективных осушителей. P4O10 - сильный
дегидратирующий агент, напр.: 4HClO4 + P4O10 (НРО3)4 + 2Cl2O7. Превращает также
H2SO4 в SO3, HNO3 - в N2O4,
амиды - в нитрилы и т.д. Реагирует как со спиртами, зфирами, так и с фенолами,
к-тами и др.; при этом происходит разрыв связей P —О —P и образуются
фосфорорг. соединения. Реагирует с NH3 и с галогеноводородами, давая
соотв. конденсированные фосфаты аммония и оксигалогениды P. С основными оксидами
в зависимости от условий образует разл. фосфаты.
(НРО3)4 + 2Cl2O7. Превращает также
H2SO4 в SO3, HNO3 - в N2O4,
амиды - в нитрилы и т.д. Реагирует как со спиртами, зфирами, так и с фенолами,
к-тами и др.; при этом происходит разрыв связей P —О —P и образуются
фосфорорг. соединения. Реагирует с NH3 и с галогеноводородами, давая
соотв. конденсированные фосфаты аммония и оксигалогениды P. С основными оксидами
в зависимости от условий образует разл. фосфаты.
Газофазная полимеризация
P4O10 с образованием полифосфатов на твердых пористых
оксидных системах обеспечивает широкие возможности создания новых композиционных
не-орг. материалов с заданными св-вами. Разработаны методы введения полифосфатных
пленок р-цией P4O10 с оксидами-модификаторами, входящими
в состав пористых керамич. систем (напр., форстерита 2MgO·SiO2);
хемосорбция паров P4O10 на пористой системе приводит к
образованию слоев полифосфатов. Полученный материал обладает повышенной стойкостью
к плавиковой к-те.
Технол. процесс произ-ва
P4O10 (рис. 4) включает окисление элементного P предварительно
осушенным воздухом, осаждение P4O10 и очистку отходящих
газов. Окисляют P в камере сжигания. Для диспергирования P в форсунку подается
воздух под давлением 500-600 кПа, осн. объем воздуха поступает через завихритель
спирального типа. Сжигание P -экзотермич. процесс: P4 + 5O2 P4O10 + 24534,6 кДж. Реально P4O10
образуется по значительно более сложному механизму.
P4O10 + 24534,6 кДж. Реально P4O10
образуется по значительно более сложному механизму.
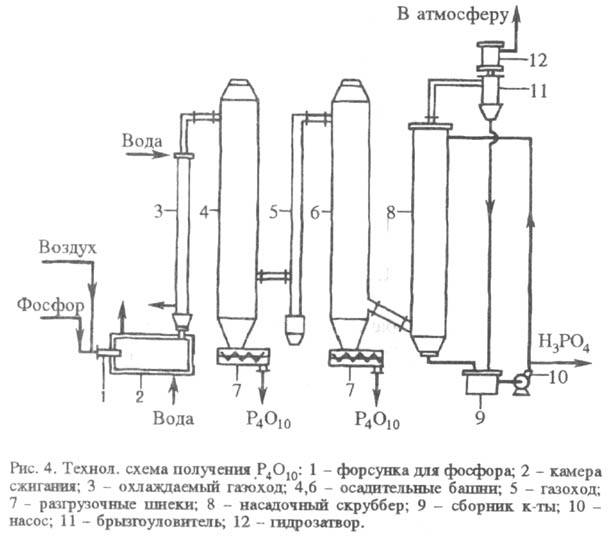
Ок. 20% теплоты отводится
охлаждающей водой, остальное тепло выделяется в газовую фазу. Из камеры сжигания
P4O10 вместе с газами направляется через водоохлаждаемый
газоход в две осадительные башни. В газоходе газы охлаждаются и происходит частичная
конденсация ультрафосфорной к-ты, к-рая сорбирует находящиеся в продуктах р-ции
примеси (оксиды тяжелых металлов и мышьяк). Конденсирующийся ниже 364 0C
P4O10 осаждается в виде белого порошка на стенках в нижней
части башен. В первой башне, где образуется более крупнокристаллич. продукт,
конденсируется свыше
75% от общего содержания P4O10, во второй - ок. 23%. Товарный
P4O10 представляет собой в осн. гексагон. H-форму.
P4O10
- осушитель газов и жидкостей, промежут. продукт в произ-ве H3PO4
термич. способом, его используют в орг. синтезе в р-циях дегидратации и конденсации,
в произ-ве ПАВ, фосфатных стекол и др. неорг. материалов и т.д.
P4O10
токсичен, вызывает ожоги кожи, раздражает слизистые оболочки, ГШК в воздухе,
рабочей зоны 1 мг/м3, в атм. воздухе 0,05 мг/м .
Триоксид фосфора (пероксид
фосфора) PO3 (по нек-рым данным, P2O6 или P4O11)
- твердое в-во фиолетового цвета из-за примесей; стабилен в течение 120-150
ч при 17-37 0C в сухой атмосфере; разлагается при 127 0C,
выделяя O2; при гидратации PO3 или его димера образуются
пероксо-фосфорная или пероксопирофосфорная к-ты; с оксидами металлов дает пероксофосфаты;
образуется при действии на пары P4O10 электрич. разряда
в вакууме (133,3 Па).
Лит. см. при ст.
Фосфорная кислота. H. В. Букколини.
===
Исп. литература для статьи «ФОСФОРА ОКСИДЫ»: нет данных
Страница «ФОСФОРА ОКСИДЫ» подготовлена по материалам химической энциклопедии.
|

