|
ФРИДЛЕНДЕРА СИНТЕЗ,
получение производных хино-лина конденсацией ароматич. ортоаминокарбонильных
соед. с в-вами, содержащими в молекуле группировку CH2C(O), напр.:
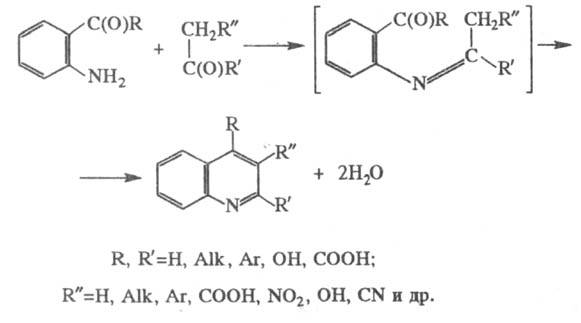
Обычно смесь реагентов
в этаноле нагревают неск. часов в присут. каталитич. кол-в NaOH, KOH, K2CO3
или пиперидина. Р-цию с альдегидами чаще проводят без катализатора; в нек-рых
случаях (напр., при получении 2-метилхино-лина) наиб. выходы достигаются при
использовании кислых
катализаторов в отсутствие р-рителя. Р-ция не идет с 1,2-дифенилэтаноном, глюкозой
и левулиновой к-той. Выходы колеблются в очень широких пределах (макс.- 70-80%).
Ф. с. имеет наиб. значение
для синтеза хинолинов, замещенных в пиридиновом кольце (прежде всего 3-замещен-ных
хинолинов, к-рые трудно получить др. методами). В случае несимметричных метилкетонов
группа CH3 занимает в хинолине положение 2. В нек-рых случаях строение
образующихся продуктов зависит от условий осуществления р-ции, напр.:
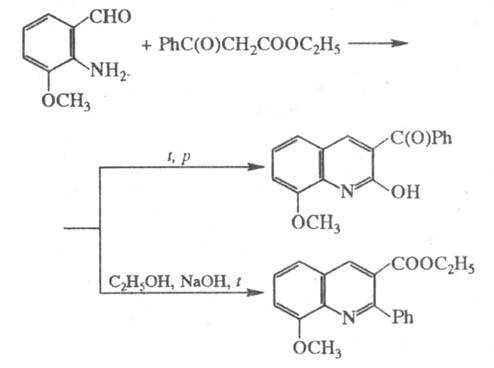
Осн. побочные продукты
- смолы, образующиеся в результате олигомеризации исходных продуктов.
Считается, что Ф. с. включает
две стадии - на первой образуется основание Шиффа, на второй происходит замыкание
цикла (при этом выделяется H2O за счет карбонильного атома О и атомов
H др. компонента).
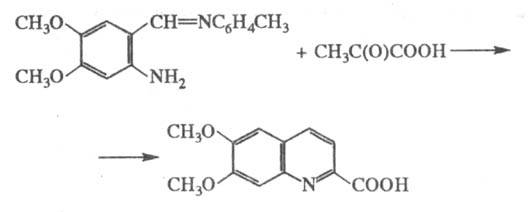
Модификация Борше-Рида:
использование оснований Шиффа вместо менее устойчивых орто-аминокарбо-нильных
соед., что особенно удобно при синтезе хинолинов, замещенных в бензольном ядре.,
напр.:
Ф. с. применяют в лаб.
практике. Открыта П. Фридленде-ром в 1882.
===
Исп. литература для статьи «ФРИДЛЕНДЕРА СИНТЕЗ»: Гетероциклические
соединения, под ред. P. Эльдерфилда, пер. с англ., т. 4, M., 1955, с. 35; там
же, т. 7, M., 1965, с. 171; FergstromF., "Chem. Rev.", 1944, v.
35, p. 151. Г.И. Дрозд.
Страница «ФРИДЛЕНДЕРА СИНТЕЗ» подготовлена по материалам химической энциклопедии.
|

