|
ЦИКЛОПРОПАН (триметилен), мол. м.
42,08; бесцв. газ, т. пл. -127 °С, т. кип. -33 °С;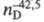 1,3799,
1,3799,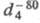 0,7352;
раств. в орг. р-рителях, плохо - в воде; легко воспламеняется; смеси с
воздухом, О2 и N2O взрывоопасны. 0,7352;
раств. в орг. р-рителях, плохо - в воде; легко воспламеняется; смеси с
воздухом, О2 и N2O взрывоопасны.

Ц. - простейший циклоалкан,
трехчленный
цикл к-рого обладает значит. энергией напряжения (~ 115 кДж/моль) и повышенной
по сравнению с др. циклоалканами хим. активностью. Углы в Ц. 60° (ССС),
114-115° (НСН), длины связей 0,151 (С —С) и 0,109 нм (С —Н). Малая величина
угла ССС по сравнению с углом между sр3-гибридизованными
орбиталями (109,5°) позволяет предположить, что при образовании связей
С — С в Ц. не достигается макс. перекрывание атомных орбиталей. Такие связи
наз. "банановыми" (рис.), по своему характеру они являются промежуточными
между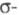 и
и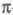 -связями,
поэтому Ц. может вести себя подобно олефинам. Кроме того, благодаря слабости
"банановой" связи, Ц. легко раскрывает кольцо в разл. р-циях. Возможны
др. способы описания характера и св-в связей в Ц. -связями,
поэтому Ц. может вести себя подобно олефинам. Кроме того, благодаря слабости
"банановой" связи, Ц. легко раскрывает кольцо в разл. р-циях. Возможны
др. способы описания характера и св-в связей в Ц.
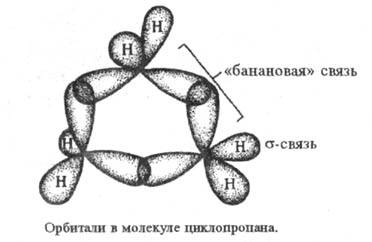
Замещение в Ц. значительно изменяет его
геометрию. Так, электронодонорные заместители укорачивают прилежащие связи
С — С и удлиняют противолежащую; электроноакцепторные группы действуют
наоборот; объемные вицинальные заместители удлиняют связь между атомами
С, несущими эти заместители. В высоконапряженных структурах при сочленении
Ц. с др. циклами, в т. ч. циклопропановыми, наблюдаются большие искажения
3-членного цикла (см. Напряжение молекул).
Ц.- слабая СН-к-та: рКа46
(вода, 25 °С).
Легко протекает изомеризация Ц. в пропен;
р-ция осуществляется термически или в присут. каталитич. кол-в Pt, Pd,
Fe, Ni, Rh, A12O3.
При действии Н2 алкилциклопропаны
в мягких условиях подвергаются гидрогенолизу либо изомеризации с послед.
гидрированием:
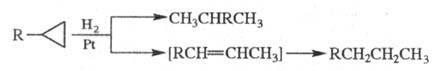
Р-ция Ц. с протонными к-тами приводит к
пропилгалогенидам. В присут. А1С13 Ц. алкилирует ароматич. соед.
с образованием как пропильных, так и изопропильных производных; при этом
при переходе от n-ксилола к о-дихлорбензолу соотношение указанных
изомеров изменяется от (92 : 8) до (4 : 96) соотв.
С хлором и бромом Ц. реагирует неодинаково.
В условиях радикального бромирования образуется 1,3-дибромпропан, а радикального
хлорирования в мягких условиях - 1,1-дихлорциклопропан. При электроф. бромировании
получают смесь бромпропанов:
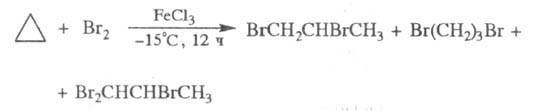
Р-ция Ц. и его производных с солями ртути
в среде протонных р-рителей приводит к -меркурир.
спиртам [или их алкокси(ацилокси)производным]; р-ция не имеет аналогов
в химии др. карбоциклов: -меркурир.
спиртам [или их алкокси(ацилокси)производным]; р-ция не имеет аналогов
в химии др. карбоциклов:
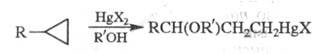
R'=H,Alk, Ас
Замещенные Ц., содержащие электронодонорные
и электроноакцепторные группы, при умеренном нагревании претерпевают гетеролиз
по наиб. замещенной связи, напр.:
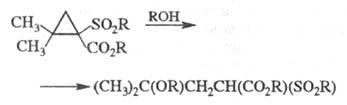
1,1-Дигалогенциклопропаны при действии
(C4H9)3SnH или Mg в СН3ОН восстанавливаются
в моногалогениды, а при взаимод. с CH3Li превращаются в соответствующие
аллены:
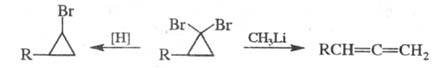
Ц. и его производные получают действием
Zn-пыли на 1,3-дигалогениды:
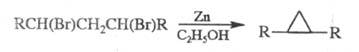
Для синтеза функционально замещенных Ц.
используют р-ции внедрения по связи С = С при действии диазоэфиров (кат.-
комплексы Сu и Rh) или диазометана, генерируемого в присут. комплексов
Pd; элиминирование HHal из галогензамещенных
кетонов, эфиров или нитрилов; взаимод. олефинов с СН2I2
в присут. пары Zn - Сu (см. Симмонса-Смита реакция); термич. разложение
пиразолинов: галогензамещенных
кетонов, эфиров или нитрилов; взаимод. олефинов с СН2I2
в присут. пары Zn - Сu (см. Симмонса-Смита реакция); термич. разложение
пиразолинов:
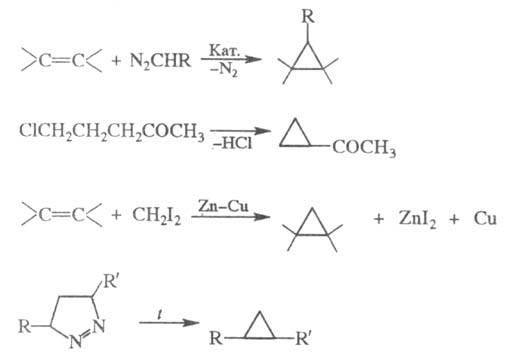
Галогенциклопропаны получают внедрением
галогенкарбенов в олефины.
Ц. и его фторпроизводные применяют в медицине
как средства для ингаляц. наркоза. Эфиры циклопропанкарбоновой к-ты - средства
защиты растений (см. Пиретроиды).
===
Исп. литература для статьи «ЦИКЛОПРОПАН»: Яновская Л. А., Домбр овский
В. А., Хусид А. X., Циклопропаны с функциональными группами, М., 1980;
Иоффе А.И., Святкин В.А., Нефедов О. М., Строение производных циклопропана,
М., 1986; Houben-Weyl, Metoden der organischen Chemie, 4 Aufl., Bd 13,
Tl 2a, Stuttg., 1973.
Ю. В. Томилов.
Страница «ЦИКЛОПРОПАН» подготовлена по материалам химической энциклопедии.
|

