ЩАВЕЛЕВАЯ КИСЛОТА
(этавдиовая
к-та) НООС — СООН, мол. м. 90,04; бесцв. гигроскопичные кристаллы; существует
в двух модификациях: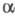 -форма,
решетка ромбич. бипирамидальная (а = 0,646 нм, b = 0,779
нм, с = 0,602 нм, z = 4; пространств. группа Рbса); -форма,
решетка ромбич. бипирамидальная (а = 0,646 нм, b = 0,779
нм, с = 0,602 нм, z = 4; пространств. группа Рbса);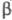 -форма,
решетка моноклинная (а - 0,530 нм, b = 0,609 нм, с =
0,551 нм; -форма,
решетка моноклинная (а - 0,530 нм, b = 0,609 нм, с =
0,551 нм;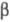 =115,5°;
z = 2; пространств, группа Р21/с); т. пл. 189,5°С; возгоняется
при 125 oС; =115,5°;
z = 2; пространств, группа Р21/с); т. пл. 189,5°С; возгоняется
при 125 oС;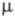 0,1 x 10-30 Кл x м (диоксан);
0,1 x 10-30 Кл x м (диоксан);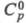 108,8 Дж/(моль x град);
108,8 Дж/(моль x град);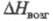 90,58
кДж/моль; 90,58
кДж/моль;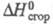 -251,4 кДж/моль;
-251,4 кДж/моль;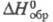 -817,38
кДж/моль; К1 5,36 x 10-2, К25,42
x 10-5 (вода, 25 °С). Р-римость (г в 100 мл р-рителя): вода
6,6 ( -817,38
кДж/моль; К1 5,36 x 10-2, К25,42
x 10-5 (вода, 25 °С). Р-римость (г в 100 мл р-рителя): вода
6,6 ( растворения
-9,58 кДж/моль), этанол 33,7, диэтиловый эфир 16,9. Образует дигидрат,
бесцв. моноклинные кристаллы (параметры решетки: а = 0,612 нм, b
= 0,361 нм, с =1,203 нм; растворения
-9,58 кДж/моль), этанол 33,7, диэтиловый эфир 16,9. Образует дигидрат,
бесцв. моноклинные кристаллы (параметры решетки: а = 0,612 нм, b
= 0,361 нм, с =1,203 нм;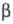 =106,2°;
z = 2; пространств. группа P21/n), т. пл. 101,5
°С; плотн. 1,653 г/см3; р-римость (г в 100 мл р-рителя): вода
9,5 (15 °С), 120 (90 °С), этанол 23,7 (15 °С), диэтиловый эфир 1,37 (20
°С); не раств. в хлороформе, петролейном эфире и бензоле. =106,2°;
z = 2; пространств. группа P21/n), т. пл. 101,5
°С; плотн. 1,653 г/см3; р-римость (г в 100 мл р-рителя): вода
9,5 (15 °С), 120 (90 °С), этанол 23,7 (15 °С), диэтиловый эфир 1,37 (20
°С); не раств. в хлороформе, петролейном эфире и бензоле.
Щ. к. обладает хим. св-вами, характерными
для карбоновых кислот, образуя два ряда производных. Соли и эфиры
Щ. к. наз. оксалатами. Известны молекулярные соед. Щ. к. с кислыми оксалатами,
напр. т. наз. кисличная соль KHC2O4
x H2O4O,
и комплексные соед. оксалатов с переходными металлами, напр. K2[Fe(C2O4)2].
Щ. к. образует кислые и средние эфиры, амиды, хлорангидрид, нитрил - циан
(табл.).
СВОЙСТВА НЕКОТОРЫХ ПРОИЗВОДНЫХ ЩАВЕЛЕВОЙ
КИСЛОТЫ
|
Соединение
|
Мол. м.
|
Т. пл., oС
|
Т. кип., °С
|
|
|
|
Диметилоксалат
(СООСН3)2
|
118,088
|
54
|
163,5
|
1,148a
|
—
|
|
Диэтилоксалат
(COOC2H5)2
|
146,14
|
-40,6
|
185,4
|
1,0785
|
1,4104
|
|
Дибугалоксалат
(СООС4Н9)2
|
202,24
|
-29,6
|
245,5
|
0,9873
|
1,424
|
|
Оксалилхлорид
(СОСl)2
|
126,93
|
-12
|
64
|
1,43
|
1,434б
|
|
Оксамид (CONH2)2
|
88,072
|
419
|
—
|
—
|
—
|
|
Циан (дициан)
(CN)2
|
52,035
|
-27,83
|
-21,15
|
0,9577в
|
—
|
а При 54 °С, б
при
12,9 оС, с при -26,89 °С.
Щ. к. содержится в щавеле в виде оксалата
калия.
В пром-сти Щ. к. получают окислением углеводов,
спиртов или гликолей смесью HNO3 и H2SO4
в присут. V2O5, либо окислением этилена или ацетилена
HNO3 в присут. PdCl2 или Pd(NO3)2,
а также окислением пропилена жидкой NO2. Перспективен способ
получения Щ. к. из СО через формиат Na:
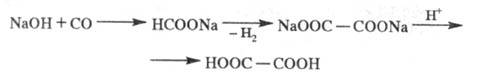
Щ. к. и ее соли применяют в текстильной
и кожевенной пром-сти в качестве протравы, как компонент анодных ванн для
осаждения пленок Al, Ti и Sn, как реагент в аналит. и орг. химии, компонент
составов для очистки металлов от ржавчины и оксидов, для осаждения РЗЭ.
Оксамид - стабилизатор нитратов целлюлозы, циан - реагент в орг. синтезе,
оксалилхлорид - хлорирующий (для замены ОН на С1), хлоркарбонилирующий
и сшивающий агент в орг. синтезе. Диалкилоксалаты, гл. обр. диэтилоксалат
и дибутилоксалат, применяют в качестве р-рителей целлюлозы и нитроцеллюлозы,
нек-рые эфиры Щ. к. и замещенных фенолов - в качестве хемилюминесцентных
реагентов.
Щ. к. и ее соли токсичны, ПДК в воде водоемов
хозяйств.-бытового пользования 0,2 мг/л.
===
Исп. литература для статьи «ЩАВЕЛЕВАЯ КИСЛОТА»: Фрейдлин Г.Н., Алифатические
дикарбоновые кислоты, М., 1978; Общая органическая химия, пер. с англ.,
т. 4, М., 1983; Kirk-Othmer encyclopedia, 3 ed., v. 16, N. Y., 1981, p.
618-36.
С. К. Смирнов, О. А. Антонкина.
Страница «ЩАВЕЛЕВАЯ КИСЛОТА» подготовлена по материалам химической энциклопедии.
|

