|
ЩЕЛОЧНОЗЕМЕЛЬНЫЕ
ЭЛЕМЕНТЫ: кальций Са,
стронций Sr, барий Ва, радий Ra; металлы. Название сохранилось
со времен алхимиков, оксиды Щ. э. по хим. св-вам напоминают оксиды щелочных
металлов и "землю" - оксид Аl, входящий в состав глин. Щ. э. имеют серебристый
металлич. блеск, кристаллизуются в кубич. решетке, для Са, Sr и Ва характерен
полиморфизм. На воздухе Щ. э. покрываются голубовато-серой пленкой, содержащей
МО, МСО3 и отчасти МО2 и M3N2, где
М - Щ. э. Т-ры плавления Са, Sr, Ва и Ra равны соотв. 842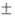 3,
768 3,
768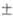 3, 727 3, 727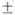 3
и 969 "С. Окисление Щ. э. на воздухе может сопровождаться воспламенением, Ва
загорается уже при резке и раздавливании, поэтому Щ. э. хранят под слоем обезвоженного
керосина. Все они ковки, пластичны и путем давления и резания м. б. превращены
в прутки, листы, проволоку. Радий радиоактивен (Т1/2 1600 лет); подвергаясь 3
и 969 "С. Окисление Щ. э. на воздухе может сопровождаться воспламенением, Ва
загорается уже при резке и раздавливании, поэтому Щ. э. хранят под слоем обезвоженного
керосина. Все они ковки, пластичны и путем давления и резания м. б. превращены
в прутки, листы, проволоку. Радий радиоактивен (Т1/2 1600 лет); подвергаясь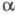 -распаду,
он превращается в радон. -распаду,
он превращается в радон.
По реакц. способности Щ. э. близки к щелочным,
их стандартные электродные потенциалы для полур-ции М2+ + 2е-
= М равны -2,864 (Са), -2,888 (Sr), -2,905 (Ва) и -2,916 В (Ra). Поэтому
все они - сильные восстановители, быстро реагируют с водой, превращаясь
в М(ОН)2 с выделением Н2, а с разб. к-тами дают соли
и Н2. Медленно реагируют с конц. HNO3 и H2SO4,
образуя нитраты с выделением NO2 и сульфаты с выделением SO2
и Н2.
Щ. э. раств. в жидком NH3,
образуя р-ры, обладающие металлич. проводимостью. При испарении из них
NH3 при низких т-рах выделяются кристаллич. комплексы [М(МН3)6]0
с металлич. блеском (похожи на бронзу), обладающие электронной проводимостью.
Щ. э. горят в О2, давая оксиды
МО, с Н2О2 образуют белые твердые пероксиды МО2,
а Ва превращается в пероксид уже на воздухе при нагр. до 400 °С. Получены
желтые кристаллич. надпероксиды М(О2)2. С галогенами
Щ. э. дают бесцв. кристаллич. галогениды, с Н2 при натр.- бесцв.,
твердые, нелетучие гидриды МН2. В среде N2 при 250-450
°С превращаются в бесцв. тугоплавкие нитриды М3N2,
при нагр. с В, С, Р -соотв. в черные кристаллич. бориды МВ6,
бесцв. твердые ацетилениды МС2, красно-бурые фосфиды М3Р2.
Стехиометрич. смеси Щ. э. с S при нагр. образуют бесцв. кристаллич. сульфиды
MS. С газообразным NH3 при -10 °С или с жидким NH3
Щ. э. дают аммиакаты [M(NH3)6], в среде СО2,
особенно выше 100 oС,- смесь МО и МС2. Щ. з. образуют
сплавы со мн. металлами (Al, Cu, Cd, Mg, Pb и т.д.), с Hg - амальгамы.
Растворимые в воде соли Щ. э.- ацетаты,
галогениды (кроме фторидов), нитраты, тетраоксохлораты(VII), сульфиды,
тиоцианаты и цианиды; нерастворимые - карбонаты, сульфаты, фосфаты, хроматы.
Летучие соли Щ. э. окрашивают пламя газовой горелки в оранжево-красный
(Са), карминово-красный (Sr), желтовато-зеленый (Ва) цвета.
Щ. э. получают восстановлением оксидов
алюминием в вакууме выше 1200 °С, Са - также электролизом расплава СаСl2.
Иногда к Щ. э. относят также Be и Mg.
===
Исп. литература для статьи «ЩЕЛОЧНОЗЕМЕЛЬНЫЕ ЭЛЕМЕНТЫ»: Степин Б. Д., Цветков А. А.,
Неорганическая химия, М., 1994.
Б. Д. Степин.
Страница «ЩЕЛОЧНОЗЕМЕЛЬНЫЕ ЭЛЕМЕНТЫ» подготовлена по материалам химической энциклопедии.
|

