ЭЛЕКТРОКАТАЛИЗ, изменение скорости или направления электрохим. процесса в зависимости от материала электрода или модификации его пов-сти. Термин "Э." относят к процессам, общие стехиометрич. ур-ния к-рых не включают материал электрода, напр. выделение водорода, кислорода, хлора, электроокисление или электровосстановление орг. соединений и т. п. Электрохим. р-ции типа анодного растворения меди (Сu Сu2+ + 2е) или катодного восстановления анионов Сu2+ + 2е) или катодного восстановления анионов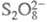 до до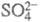 к электрокаталитическим не относятся. к электрокаталитическим не относятся.
Как правило, электрокаталитическими являются многостадийные процессы, в к-рых одной из обязат. стадий является адсорбция на электроде тех или иных компонентов электродной р-ции (исходных, промежуточных или конечных). Это связано с тем, что с учетом структуры двойного электрического слоя скорость р-ции, не сопровождающейся адсорбцией, оказывается практически не зависящей от материала электрода. Нек-рые ученые относят к Э. лишь процессы, в к-рых имеет место хемосорбция к.-л. компонентов р-ции.
Типичным злектрокаталитич. процессом является электроокисление орг. соед. на металлах платиновой группы, к-рое, как правило, сопровождается деструкцией исходных молекул, их дегидрированием (или их фрагментов), прочной хемосорбцией промежут. частиц, причем нек-рые из этих частиц м. б. каталитич. ядами по отношению к токоопределяющему маршруту анодного процесса. Так, электрокаталитич. окисление предельных углеводородов (C1-C6) на Pt-электроде до СО2 обусловлено наличием сложной цепочки промежут. стадий, включающей разрыв связей С — С, С — Н, хемосорбцию фрагментов исходных молекул на пов-сти металла-катализатора, участие в отд. стадиях адсорбир. молекул Н2Оадс или частиц ОНадс и т. п. Граница между "чисто электрохимич." и электрокаталитич. р-циями является весьма условной.
Осн. отличие электрокаталитич. р-ций от гетерогенно-каталитических - зависимость скорости процесса от потенциала электрода Е. Кинетич. ур-ние электрокаталитич. р-ции выражает аналит. связь между током I через электрохим. ячейку и потенциалом Е, объемной концентрацией сi исходных реагирующих в-в, поверхностными концентрациями (заполнениями пов-сти) частиц, участвующих в токоопределяющем маршруте (или маршрутах) процесса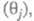 и других адсорбир. или хемосорбир. частиц, таких, как ионы р-ра, продукты превращения исходных реагентов и молекул р-рителя и т. п. и других адсорбир. или хемосорбир. частиц, таких, как ионы р-ра, продукты превращения исходных реагентов и молекул р-рителя и т. п.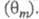 В общем виде это выражение можно записать след. образом: В общем виде это выражение можно записать след. образом:
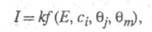
где k - постоянная. Меняя Е, можно на неск. порядков изменить скорость целевой р-ции; при этом значение Е влияет как на энергию активации р-ции, так и (в осн.) на поверхностные концентрации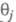 и и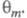 Во мн. случаях с изменением Е меняются не только Во мн. случаях с изменением Е меняются не только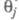 и и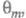 но и природа частиц j и т, что приводит к изменению направления электродного процесса. В Э., как и в жидкофазном катализе, важную роль играет адсорбция р-рителя, однако спецификой Э. является возможность участия в разл. стадиях процесса частиц, образующихся в результате электрохим. р-ций с участием р-рителя (напр., в водных р-рах - частиц Надс и ОНадс). Другая особенность Э.-адсорбция на пов-сти ионов фонового электролита и ее влияние на электродные р-ции. но и природа частиц j и т, что приводит к изменению направления электродного процесса. В Э., как и в жидкофазном катализе, важную роль играет адсорбция р-рителя, однако спецификой Э. является возможность участия в разл. стадиях процесса частиц, образующихся в результате электрохим. р-ций с участием р-рителя (напр., в водных р-рах - частиц Надс и ОНадс). Другая особенность Э.-адсорбция на пов-сти ионов фонового электролита и ее влияние на электродные р-ции.
Строгой теории, связывающей физ. и хим. св-ва металла с его электрокаталитич. активностью, не существует даже для относительно простых и ярко выраженных случаев Э. Это относится и к наиб. изученной р-ции - ионизации-разряда водорода, ток обмена к-рой в зависимости от природы электрода меняется более чем на 10 порядков (наименее активны Hg, Cd, Pb, наиб. активны Pt, Rh, Ir). Представления о механизме Э. пока носят феноменологич. характер. Влияние на скорость р-ции материала электрода связывается прежде всего с изменением энергии адсорбции и степени заполнения пов-сти частицами j и т. К наиб. активным электродным материалам относятся металлы группы Pt и Ni, что, по-видимому, в первую очередь обусловлено их высокой адсорбционной (хемосорбционной) способностью. В этом отношении Э. аналогичен гетерогенному катализу.
Из неметаллич. электрокатализаторов неорг. природы (оксидов, карбидов, сульфидов и др.) наиб. изучены оксидные системы и углеродные материалы. Устойчивость оксидов при высоких анодных потенциалах объясняет их преим. использование в р-циях электроокисления и электросинтеза (типичный пример - применение оксидных рутениево-титановых анодов ОРТА в процессе выделения хлора). Большое число функц. групп на пов-сти углеродных материалов позволяет осуществлять на них широкий круг электрокаталит. процессов с достаточно высокой селективностью.
Активность смешанных электрокатализаторов, состоящих из неск. компонентов, часто оказывается выше активности отд. составляющих. Напр., скорость электроокисления метанола на сплаве Pt-Ru повышается на 3 порядка по сравнению со скоростью процесса на Pt. Выяснение причин повышения активности при переходе к смешанным катализаторам включает прежде всего установление корреляций между объемными и поверхностными св-вами электрода, поскольку даже элементный состав поверхностного слоя нередко может существенно отличаться от объемного состава.
В Э. широко используют модифицирование пов-сти домонослойными, моно- или полислойными покрытиями. Адатомы, образующиеся в результате адсорбции ионов с практически полным переносом заряда (напр., Sn2+ + 2e Snадс), также нередко активируют пов-сть. Модифицирование пов-сти разл. непроводящими орг. соед., включая металлоорг. комплексы и полимеры, позволяет создавать системы со специфич. адсорбционными и каталитич. св-вами, обусловленными в первую очередь функц. группами модификатора. Для таких систем часто используют назв. "химически модифицированные электроды". Ускорение электрохим. р-ций в присутствии биол. катализаторов - ферментов - часто наз. биоэлектрокатализом. Snадс), также нередко активируют пов-сть. Модифицирование пов-сти разл. непроводящими орг. соед., включая металлоорг. комплексы и полимеры, позволяет создавать системы со специфич. адсорбционными и каталитич. св-вами, обусловленными в первую очередь функц. группами модификатора. Для таких систем часто используют назв. "химически модифицированные электроды". Ускорение электрохим. р-ций в присутствии биол. катализаторов - ферментов - часто наз. биоэлектрокатализом.
Впервые термин "Э." был использован Н. И. Кобозевым и В. В. Монблановой в 1934. Как самостоят. научное направление Э. сформировался в 60-х гг. 20 в. в связи с проблемой создания топливных элементов. Широкое развитие работ по Э. вызвано прежде всего запросами практики. Активные и селективные электрокатализаторы необходимы для создания высокоэкономичных процессов электролиза (в произ-вах водорода, кислорода, хлора и т. д.) и электрохим. генераторов (водород-кислородных, на орг. топливе и др.), для проведения и интенсификации электросинтеза орг. и неорг. соед., разработки разнообразных датчиков (в т. ч. мед. назначения), решения проблем экологии.
Лит.: Проблемы электрокатализа, под ред. B.C. Багоцкого, М, 1980; Электродные процессы в растворах органических соединений, под ред. Б. Б. Дамаскина, М., 1985; Appleby A. J., в кн.: Comprehensive treatise of electrochemistry, v. 7, N. Y.- L., 1983, p. 173-239.
Б. И. Подловченко. |

