ЭЛЕКТРОПРОВОДНОСТЬ ЭЛЕКТРОЛИТОВ, способность электролитов проводить электрич. ток при приложении электрич. напряжения. Носителями тока являются положительно и отрицательно заряженные ионы - катионы и анионы, к-рые существуют в р-ре вследствие электролитич. диссоциации. Ионная Э. э., в отличие от электронной, характерной для металлов, сопровождается переносом в-ва к электродам с образованием вблизи них новых хим. соед. (см. Электролиз). Общая (суммарная) проводимость состоит из проводимости катионов и анионов, к-рые под действием внешнего электрич. поля движутся в противоположных направлениях. Доля общего кол-ва электричества, переносимого отд. ионами, наз. числами переноса, суммак-рых для всех видов ионов, участвующих в переносе, равна единице.
Количественно Э. э. характеризуют эквивалентной электропроводностью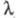 - проводящей способностью всех ионов, образующихся в 1 грамм-эквиваленте электролита. Величина - проводящей способностью всех ионов, образующихся в 1 грамм-эквиваленте электролита. Величина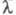 связана с уд. электропроводностью связана с уд. электропроводностью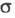 соотношением: соотношением:
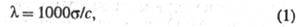
где с - концентрация р-ра в г-экв/л. Эквивалентная электропроводность зависит от природы растворенного в-ва и р-рителя, структуры р-ра, а также от концентрации, т-ры, давления. Предельно разбавленному р-ру, в к-ром все молекулы диссоциированы на ионы, соответствует предельное значение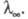 В соответствии с Кольрауша законом В соответствии с Кольрауша законом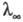 равна сумме эквивалентных электропроводностей катионов и анионов. Эквивалентная электропроводность отд. иона пропорциональна скорости его движения в р-ре и характеризует подвижность иона в р-ре. равна сумме эквивалентных электропроводностей катионов и анионов. Эквивалентная электропроводность отд. иона пропорциональна скорости его движения в р-ре и характеризует подвижность иона в р-ре.
Описание концентрац. зависимости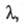 как и других св-в р-ров электролитов (см. Растворы электролитов), обычно базируется на ионном подходе, в рамках к-рого р-ритель рассматривается как бесструктурная диэлектрич. среда, в к-рой ионы движутся в соответствии с законами гидродинамики и характером межионного взаимодействия. Простейшей моделью является модель заряженных твердых сфер, движущихся в вязком р-рителе под влиянием силы, обусловленной градиентом потенциала. При этом сила сопротивления движению иона в р-ре определяется ур-нием Стокса (см. Вискозиметрия). В рамках применимости этого ур-ния выполняется правило Вальдена-Писаржевского, в соответствии с к-рым для одного и того же электролита в любых р-рителях произведение предельного значения эквивалентной электропроводности как и других св-в р-ров электролитов (см. Растворы электролитов), обычно базируется на ионном подходе, в рамках к-рого р-ритель рассматривается как бесструктурная диэлектрич. среда, в к-рой ионы движутся в соответствии с законами гидродинамики и характером межионного взаимодействия. Простейшей моделью является модель заряженных твердых сфер, движущихся в вязком р-рителе под влиянием силы, обусловленной градиентом потенциала. При этом сила сопротивления движению иона в р-ре определяется ур-нием Стокса (см. Вискозиметрия). В рамках применимости этого ур-ния выполняется правило Вальдена-Писаржевского, в соответствии с к-рым для одного и того же электролита в любых р-рителях произведение предельного значения эквивалентной электропроводности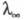 на вязкость р-рителя на вязкость р-рителя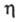 является постоянной величиной, к-рая не зависит от природы р-рителя, но является ф-цией т-ры. Сравнительно хорошо это правило выполняется только для слабо сольватир. ионов, в частности ионов, имеющих большие размеры в кристаллич. фазе. С увеличением концентрации значение является постоянной величиной, к-рая не зависит от природы р-рителя, но является ф-цией т-ры. Сравнительно хорошо это правило выполняется только для слабо сольватир. ионов, в частности ионов, имеющих большие размеры в кристаллич. фазе. С увеличением концентрации значение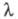 уменьшается в осн. в р-рах слабых электролитов и в области малых концентраций удовлетворительно описывается законом разведения Оствальда (см. Электролитическая диссоциация). уменьшается в осн. в р-рах слабых электролитов и в области малых концентраций удовлетворительно описывается законом разведения Оствальда (см. Электролитическая диссоциация).
В р-рах сильных электролитов концентрац. зависимость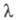 определяется межионным взаимодействием. В области применимости Дебая-Хюккеля теории имеются две причины для торможения ионов вследствие межионного взаимодействия. Первая из них связана с тем, что движение иона тормозится ионной атмосферой, к-рая имеет заряд, противоположный центральному иону, и под влиянием поля движется в направлении, противоположном перемещению иона (электрофоретич. эффект). Вторая причина связана с тем, что при движении иона под действием электрич. поля его ионная атмосфера деформируется и теряет сферич. симметрию, причем большая часть заряда ионной атмосферы концентрируется позади центрального иона (релаксац. эффект). Учет обоих эффектов приводит кур-нию Онсагера: определяется межионным взаимодействием. В области применимости Дебая-Хюккеля теории имеются две причины для торможения ионов вследствие межионного взаимодействия. Первая из них связана с тем, что движение иона тормозится ионной атмосферой, к-рая имеет заряд, противоположный центральному иону, и под влиянием поля движется в направлении, противоположном перемещению иона (электрофоретич. эффект). Вторая причина связана с тем, что при движении иона под действием электрич. поля его ионная атмосфера деформируется и теряет сферич. симметрию, причем большая часть заряда ионной атмосферы концентрируется позади центрального иона (релаксац. эффект). Учет обоих эффектов приводит кур-нию Онсагера:
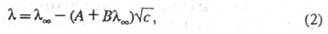
где А и В - эмпирич. постоянные, являющиеся ф-циями т-ры, вязкости и диэлектрич. проницаемости р-рителя.
Как и теория Дебая-Хюккеля, ур-ние Онсагера ограничено областью умеренно разбавленных р-ров. Для описания концентрир. р-ров возникает необходимость в учете некулоновской части межионного взаимод., в частности в учете ионных размеров. Для этой цели применяют методы кинетич. теории ионных систем. К дополнит. уменьшению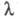 приводит образование ионных ассоциатов - пар, тройников и т. п., к-рое, как и эффект неполной диссоциации, сокращает общее число своб. ионов в р-ре. Для учета этого эффекта в ур-нии Онсагера заменяют общую концентрацию ионов концентрацией своб. ионов приводит образование ионных ассоциатов - пар, тройников и т. п., к-рое, как и эффект неполной диссоциации, сокращает общее число своб. ионов в р-ре. Для учета этого эффекта в ур-нии Онсагера заменяют общую концентрацию ионов концентрацией своб. ионов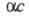 ( (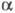 - степень электролитич. диссоциации), что приводит к ур-нию Фуосса-Онсагера: - степень электролитич. диссоциации), что приводит к ур-нию Фуосса-Онсагера:
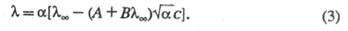
В переменных электрич. полях при достаточно высокой частоте ион не уходит далеко от центра ионной атмосферы, вследствие чего она не деформируется. Обусловленный деформацией релаксац. эффект не возникает, что приводит к увеличению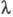 -т.наз. эффект Дебая-Фалькенхагена. Величина -т.наз. эффект Дебая-Фалькенхагена. Величина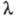 возрастает также в постоянных электрич. полях достаточно высокой напряженности (104-105 В/см). В этих условиях ионы движутся настолько быстро, что ионная атмосфера не успевает образоваться, вследствие чего практически отсутствуют и релаксац. и электрофоретич. эффекты. В результате возрастает также в постоянных электрич. полях достаточно высокой напряженности (104-105 В/см). В этих условиях ионы движутся настолько быстро, что ионная атмосфера не успевает образоваться, вследствие чего практически отсутствуют и релаксац. и электрофоретич. эффекты. В результате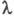 стремится к предельному значению стремится к предельному значению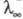 (т. наз. эффект Вина). В слабых электролитах эффект Вина вызывается также смещением диссоциативного равновесия в сильном электрич. поле в сторону образования ионов. (т. наз. эффект Вина). В слабых электролитах эффект Вина вызывается также смещением диссоциативного равновесия в сильном электрич. поле в сторону образования ионов.
Влияние т-ры и давления на Э. э. обусловлено изменением предельного значения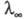 вследствие изменения структуры р-рителя и характера ион-молекулярного взаимод., изменения влияния межионного взаимод. и смещения диссоциативного равновесия. Более детальное описание механизма Э. э. в широкой области концентраций, т-р и давлений возможно в рамках ион-молекулярного подхода. При этом уд. электропроводность рассчитывают через электрич. поток j(t)= вследствие изменения структуры р-рителя и характера ион-молекулярного взаимод., изменения влияния межионного взаимод. и смещения диссоциативного равновесия. Более детальное описание механизма Э. э. в широкой области концентраций, т-р и давлений возможно в рамках ион-молекулярного подхода. При этом уд. электропроводность рассчитывают через электрич. поток j(t)=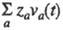 и автокорреляц. ф-цию и автокорреляц. ф-цию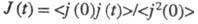 с помощью соотношения: с помощью соотношения:

где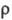 - кол-во ионов электролита в единице объема р-ра, е -элементарный электрич. заряд, - кол-во ионов электролита в единице объема р-ра, е -элементарный электрич. заряд,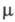 - приведенная масса катиона и аниона, za - степень окисления иона сорта a, vа(t) - его скорость в момент времени t. - приведенная масса катиона и аниона, za - степень окисления иона сорта a, vа(t) - его скорость в момент времени t.
Специфич. механизм электропроводности характерен для к-т и оснований, содержащих соотв. ионы Н+ и ОН-, к-рые в водных р-рах (или других протонных р-рителях) имеют подвижность на порядок больше остальных ионов. Для объяснения аномально высокой проводимости ионов Н+ и ОН-предполагается, что под влиянием электрич. поля протоны перемещаются не только путем миграции, но и по механизму протонного обмена, включающему перенос протона в кислой среде от ионов гидроксония Н3О+ к молекуле воды, а в щелочной - от молекулы воды к иону ОН-.
Эксперим. изучение Э. э.- важное направление физико-химического анализа, поскольку зависимость Э. э. от состава р-ра позволяет судить о концентрации солей, качественный, состав к-рых известен (см. также Кондуктометрия). Измерения l используют для определения подвижностей ионов.
Лит.: Скорчеллетти В. В., Теоретическая электрохимия, 4 изд., Л., 1974; Измайлов Н. А., Электрохимия растворов, 3 изд., М., 1976; Эрдеи-Груз Т., Явления переноса в водных растворах, пер. с англ., М., 1976. См. также лит. к ст. Растворы электролитов.
М. Ф. Головко.
|

