|
БЕРИЛЛИЙОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ, содержат связь Be—С;
общие ф-лы R2Be и RBeX, где R = Alk, Ar; X = Hal, OR, NH2,
H. Соединения типа R2Be наз. симметричными или полными, типа
RBeX-несимметричными или смешанными.
R2Be [за исключением (СН3)2Ве] - жидкости,
перегоняющиеся в высоком вакууме; раств. в большинстве орг. р-рителей;
в своб. состоянии и в р-рах ассоциированы. (СН3)2Be
- твердый полимер цепочечной структуры с тетраэдрич. расположением СН3-групп
вокруг атома Be; легко возгоняется при нагревании (в парах - димер или
тример). R2Be самовоспламеняются на воздухе и в атмосфере СО2,
бурно реагируют с водой и спиртами, образуя соотв. углеводороды и алкоголяты,
дают устойчивые комплексы с электронодонорными соед., напр. аминами, фосфинами,
эфирами (устойчивость комплексов убывает в ряду N > > Р > О). Взаимод.
(СН3)2Ве с СО2 в эфирном р-ре и послед.
гидролиз образующейся соли приводят к СН3СООН, аналогичная р-ция
(С2Н5)2Ве - к диэтилкарбинолу (С2Н5)2СНОН.
Взаимод. (СН3)2Ве с метанолом при -80°С дает димер
(СН3ВеОСН3)2, с азобензолом -[C6H5N(CH3)NC6H5]2Be.
Диметилбериллий реагирует с LiAlH4 в эфире и с жидким (СН3)2А1Н
без р-рителя с образованием соотв. гидрида ВеН2, прочно удерживающего
эфир, и СН3ВеН, а также с дибораном В2Н6,
давая Ве(ВН4)2. Термич. стойкость R2Be
невысока, напр. (изо-С3Н7)2Ве разлагается
при нагр. до 200°С или при перегонке в вакууме (40 °С) с образованием полимерного
(изо-С3Н7ВеН)х и пропилена, а [(СН3)3С]2Ве
- при 150-200 °С с образованием ВеН2 и изобутилена.
Синтезируют R2Be взаимод. ВеС12 с магнийорг. соед.
в эфире (образуются эфираты R2Be) или металлич. Be с Alk2(Ar2)Hg.
Р-цию ВеС12 с арильными и циклопентадиенильными производными
щелочных металлов используют для получения соотв. (С6Н5)2Ве
и (С5Н5)2Ве.
Соед. RBeX - твердые в-ва, хорошо р-римые в эфирах и аминах. Предполагают,
что их истинное строение м. б. представлено ф-лой R2Be*BeX2,
а в р-рах существует равновесие R2Be*BeX2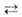 R2Be
+ BeX2. R2Be
+ BeX2.
Эти Б. с. менее реакционноспособны, чем R2Be: не реагируют
с СО2; их р-ры в эфире устойчивы на воздухе (твердые RBeX самовоспламеняются).
Взаимод. RBeX с водой приводит к углеводородам, осторожное нагревание -
к R2Be. Устойчивые эфираты получают нагреванием металлич. Be
с эфирными р-рами RX в запаянных ампулах в присут. HgCl2; индивидуальные
RBeX-длительным нагреванием металлич. Be с RX в углеводородных р-рителях.
Б. с. могут быть использованы как катализаторы димеризации и полимеризации
олефинов, а также для получения металлич. Be высокой чистоты. При работе
с Б. с. исключают их контакт с органами дыхания и кожей во избежание хронич.
заболевания - бериллиоза. ПДК 0,001 мг/м3.
===
Исп. литература для статьи «БЕРИЛЛИЙОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ»: Иоффе С.Т., Несмеянов А.Н., в кн.: Методы элементоорганической
химии. Магний. Бериллий. Кальций. Стронций. Барий, под ред. А. Н. Несмеянова
и К.А. Кочешкова, [т. 1], М, 1963, с. 468-91; GoatesG.E., Green M.L.H.,
Wade К., Organometallic compounds, 3 ed., v. 1, L, 1967, p. 103-21.
Страница «БЕРИЛЛИЙОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ» подготовлена по материалам химической энциклопедии.
|

