ЭФИРЫ ПРОСТЫЕ, соед. общей ф-лы R - О - R', где R и R' - углеводородный радикал. Различают симметричные Э. п. (R и R' одинаковы) и смешанные, или несимметричные (R и R' различны). К Э. п. относятся нек-рые виниловые эфиры, а также глимы, карбитолы, целлозольвы, гетероциклич. соед. с атомом О в цикле, напр. оксиран, оксолан, 1,4-диоксан, ТГФ и др.
Названия Э. п. производят от названий углеводородных радикалов с добавлением слова "эфир" либо по заместит. номенклатуре, используя название группы RO как приставку к названию углеводорода RH, напр. C2H5OC2H5 наз. диэтиловый эфир или этоксиэтан. Нек-рые Э. п. имеют тривиальные названия.
Э. п.- бесцв. жидкости (табл.) с характерным запахом; они не образуют межмол. водородных связей, в отличие от спиртов не ассоциированы и поэтому более летучи, чем спирты с тем же числом углеродных атомов. Э. п. плохо раств. в воде, хорошо - в орг. р-рителях, растворяют орг. соед., устойчивы к действию щелочей и щелочных металлов.
В ИК спектрах Э. п. наблюдается сильное поглощение в области 1150-1085 см-1, характеристич. полосы в видимой и УФ частях спектра отсутствуют, в спектрах ПМР хим. сдвиг 6 3,2-3,4 м. д. (для метоксиалканов) и 3,7 м. д. (для метоксиаренов).
Наличие в молекуле Э. п. атома кислорода со своб. электронной парой определяет их основные св-ва. При действии сильных протонных к-т образуются оксониевые соединения [RR'OH]+Cl- (за исключением полностью фторир. и ароматич. эфиров); с к-тами Льюиса - относительно устойчивые эфираты, напр. эфираты трифторида бора RR'O х BF3.
Иодистоводородная и бромистоводородная к-ты расщепляют алифатич. и жирно-ароматич. Э. п. на алкилгалогенид и спирт или фенол; р-ция протекает через промежуточные оксониевые соли по механизмам SN1 или SN2. Расщепление метил- и этилалкиловых эфиров посредством HI используют для количеств. определения метокси- и этоксигрупп (метод Цейзеля). Метод основан на определении иода в образовавшихся СН3I или C2H5I путем пропускания последних в р-р AgNO3 (по кол-ву осажденного AgI) либо окислением (по кол-ву выделившегося I2).
СВОЙСТВА НЕКОТОРЫХ ПРОСТЫХ ЭФИРОВ
|
Соединение |
Мол. м. |
Т.О, |
Т. кип., °С |
|
|
|
Диметиловый эфир СН3ОСН3 |
46,07 |
—— |
-25 |
— |
— |
Диэталовый эфир
С2Н5ОС2Н5 |
74,12 |
— |
34,5 |
0,7138 |
1,3526 |
|
Дипропиловый эфир С3Н7ОСH7 |
102,2 |
-122 |
90,1 |
0,7360 |
1,3809 |
|
Диизопропиловый эфир (СН3)2СНОСН(СН3)2 |
102,2 |
-86,2 |
68,5 |
0,7241 |
1,3679 |
Дибутиловый эфир
С4Н9ОС4Н9 |
130,2 |
-95,3 |
142 |
0,7704 |
1,3981 |
|
Диаллиловый эфир (СН2=СНСН2)2О |
98,2 |
— |
94,0 |
0,8060 |
1,4163 |
|
Металфениловый эфир (анизол) C6H5OCH3 |
108,13 |
-37,5 |
153,8 |
0,9954 |
1,5179 |
|
Эталфениловый эфир (фенетол) C6H5OC2H5 |
122,2 |
-29,5 |
170 |
0,9651 |
1,5073 |
|
Дифениловый эфир (днфенилоксид) С6Н5ОС6Н5 |
170,21 |
28-29 |
259,3 |
1,0748 |
1,5795 |
|
2-Метоксифенол (гваякол) 2-СН3ОС6Н4ОН |
124,13 |
28,5 |
205 |
1,1287а |
1,5385а |
|
1 ,2-Диметоксибензол (вератрол) 1,2-(СН3О)2С6Н4 |
138,2 |
22,7 |
206,1 |
1,0801в |
1,5320в |
Эталеноксид (оксиран)

|
44,0 |
-112 |
11,0 |
0,8971в |
1,3597г |
а При 21,4 °С. 6 При 25 °С. вПри 0 оС. г При 7 °С.
При действии на Э. п. алкилнатрия или алкиллития происходит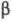 -элиминирование с образованием алкена и алкоголята: -элиминирование с образованием алкена и алкоголята:
СН3СН2ОСН2СН3 + RNa СН2 = СН2 + C2H5ONa + RH СН2 = СН2 + C2H5ONa + RH
На воздухе или в присут. О2 при нормальной т-ре Э. п. склонны к автоокислению; образующиеся пероксиды неустойчивы, легко взрываются и требуют осторожности при работе с ними. Это св-во наиб. выражено у диизопропилового эфира.
Под действием H2SO4, A1C13, BF4 и т. п. эфиры фенолов изомеризуются в орто- и пара-алкилзамещенные фенолы (наиб. легко мигрирует третичный радикал, труднее - первичный):
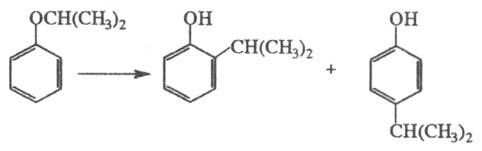
Аллилфениловые эфиры перегруппировываются в орто- или пара-аллилфенолы (см. Клайзена перегруппировка).
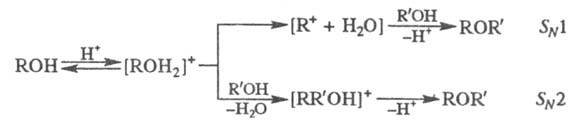
Получают несимметричные Э. п. алкилированием алкоголятов или фенолятов алкилгалогенидами (Вильямсона синтез). Для получения симметричных Э. п. используют межмол. дегидратацию спиртов в присут. конц. H2SO4. В зависимости от структуры спирта р-ция может протекать по механизму SN1 или SN2
Алкил- и арилметиловые эфиры получают взаимод. спиртов и фенолов с диазометаном в присут. к-т Льюиса (алкоголяты Al, BF3, A1C13 или HBF4), напр.:
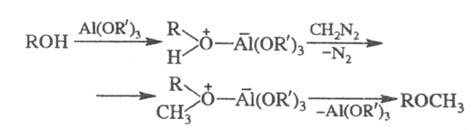
Э. п. образуются также при присоединении спиртов или фенолов к олефинам в присут. к-т (H2SO4, H3PO4, HC1, BF3):
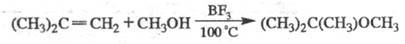
Э. п. - р-рители жиров, смол, красителей, лаков и др. Ариловые эфиры - консерванты, антиоксиданты, применяются в парфюм. пром-сти. Нек-рые Э. п. обладают инсектицидным действием.
См. также Анизол, Диизопропиловый эфир, Диметиловый эфир, Дифенилоксид, Диэтиловый эфир, Фенетол.
Лит.: Гауптман 3., Грефе Ю., Ремане X., Органическая химия, пер. с нем., М., 1979, с. 332-40; Общая органическая химия, пер. с англ., т. 2, М., 1982, с. 289-353; Kirk-Othmer encyclopedia, v. 9, N. Y., 1980, p. 381-92.
Л. Н. Максимова. |

