|
БИМОЛЕКУЛЯРНЫЕ РЕАКЦИИ, хим. р-ции, в элементарном акте к-рых
превращению подвергаются две частицы (молекулы, радикалы или ионы). В результате
могут возникать одна, две или (в редких случаях) три и более частиц продукта:
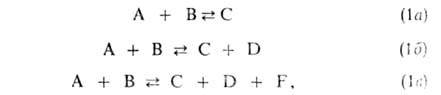
где А и В - молекулы реагентов, С, D и F - молекулы продуктов. Наиб.
обширный класс Б.р. - р-ции типа (16). бимолекулярные как в прямом, так
и в обратном направлениях. Их кинетика описывается ур-нием:
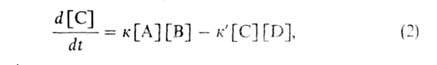
где к и к'-константы скорости р-ции соотв. в прямом и обратном направлениях,
[А], [В] и [С], [D] - концентрации реагентов и продуктов.
Реакции в газах. Поскольку в газах время между последовательными
столкновениями молекул (10-10 с при нормальных условиях) много
больше времени столкновение (10-12 - 10-13 с), влияние
среды (окружения) проявляется лишь в соударениях реагирующих молекул с
молекулами окружения до или после столкновения реагирующих молекул друг
с другом, но не за время одного столкновения. Поэтому элементарный акт
р-ции можно рассматривать как результат изолированного парного столкновения.
Tакие столкновения могут приводить к изменению числа частиц с энергией,
превышающей энергию активации р-ции Е, и нарушению максвелл-больцмановского
распределения частиц по энергиям их относит. движения и внутр. степеням
свободы. В зависимости от соотношения скоростей р-ции и процессов релаксации,
восстанавливающих это распределение, различают равновесные и неравновесные
Б. р.
Равновесные р-ции протекают сравнительно медленно, максвелл-больцмановское
распределение практически сохраняется, и скорость р-ции w м. б. рассчитана
в рамках активированного комплекса теории:
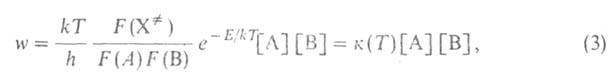
где k и h-постоянные Больцмана и Планка соотв., Т - абс.
т-ра, F(A), F(B)и F(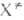 )-статистич.
суммы исходных реагентов А и В и активированных комплексов )-статистич.
суммы исходных реагентов А и В и активированных комплексов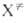 ,
к-т. наз. макроскопич. константа скорости р-ции. Поскольку ,
к-т. наз. макроскопич. константа скорости р-ции. Поскольку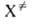 рассматривается как обычная молекула, в к-рой одна степень свободы колебат.
движения заменена степенью свободы постулат. движения вдоль координаты
р-ции, статистич. сумма F(
рассматривается как обычная молекула, в к-рой одна степень свободы колебат.
движения заменена степенью свободы постулат. движения вдоль координаты
р-ции, статистич. сумма F(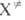 )
вычисляется как статистич. сумма обычной молекулы без одной степени свободы
колебат. движения. Для модели столкновения молекул как жестких шаров с
массами mA и mB и радиусами rА и rB
отношение статистич. сумм в (3) равно газокинетич. числу столкновений: )
вычисляется как статистич. сумма обычной молекулы без одной степени свободы
колебат. движения. Для модели столкновения молекул как жестких шаров с
массами mA и mB и радиусами rА и rB
отношение статистич. сумм в (3) равно газокинетич. числу столкновений:
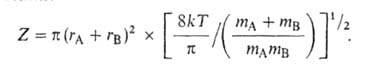
Тогда к(Т)= ZPe-E/kT, где Р-т. наз. стерич.
фактор, учитывающий вероятность наиб. благоприятной для р-ции взаимной
ориентации сталкивающихся молекул. Теория активированного комплекса позволяет
вычислить его величину в предположении, что при образовании активированного
комплекса происходит замена вращат. степеней свободы колебательными. Отсюда
следует, что для многих р-ций Р - малая величина (меньше единицы),
а их скорость намного меньше значения, рассчитанного на основе газокинетич.
теории. Следовательно, стерич. фактор действительно отражает динамич. процессы;
в частности, он зависит от вероятности образования предпочтительной для
р-ции конфигурации активированного комплекса.
Для неравновесных р-ций, скорость к-рых сравнима со скоростями релаксационных
процессов, максвелл-больцмановское распределение нарушается сильно и теория
активированного комплекса неприменима. Необходимо учитывать распределения
частиц не только по энергиям их относит. движения, но и по квантовым состояниям,
а также изменение этих распределений. Для этого стехиометрич. ур-ние (1б)записывают
в микроскопич. форме с учетом фиксированных квантовых состояний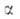 и и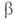 реагирующих
частиц А и В и образующихся из них квантовых состояний реагирующих
частиц А и В и образующихся из них квантовых состояний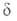 и и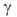 частиц продуктов С и D соотв.:
частиц продуктов С и D соотв.:
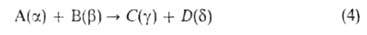
Характеристика такого парного столкновения - т. наз. интегральное сечение
р-ции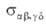 . По
физ. смыслу эта величина соответствует площади мишени, центр к-рой совпадает
с центром масс одной из реагирующих молекул, если при попадании в эту мишень
второй молекулы происходит процесс (4). Произведение скорости относит.
движения сталкивающихся частиц на интегральное сечение р-ции равно потоку
молекул, к-рые в случае "попадания" в мишень прореагировали или изменили
свое квантовое состояние, т.е. равно скорости процесса (4). Теоретич. расчет . По
физ. смыслу эта величина соответствует площади мишени, центр к-рой совпадает
с центром масс одной из реагирующих молекул, если при попадании в эту мишень
второй молекулы происходит процесс (4). Произведение скорости относит.
движения сталкивающихся частиц на интегральное сечение р-ции равно потоку
молекул, к-рые в случае "попадания" в мишень прореагировали или изменили
свое квантовое состояние, т.е. равно скорости процесса (4). Теоретич. расчет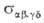 или его эксперим. определение - осн. задача динамики элементарного акта
р-ции.
или его эксперим. определение - осн. задача динамики элементарного акта
р-ции.
Скорость процесса (4) выражают через сечение р-ции и ф-цию распределения
f(и)
частиц по скоростям их относит. движения:
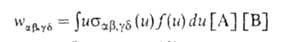
Если бимолекулярный процесс (4) не нарушает термически равновесного
распределения частиц по "скоростям, описываемого максвелловской ф-цией
fo(и,
Т), он характеризуется т. наз. микроскопич. константой скорости
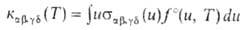 . Если
же распределение частиц реагентов остается термически равновесным не только
по скоростям их относит. движения, но и по внутр. состояниям и характеризуется
больцмановской ф-цией . Если
же распределение частиц реагентов остается термически равновесным не только
по скоростям их относит. движения, но и по внутр. состояниям и характеризуется
больцмановской ф-цией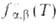 представляет интерес полная концентрация частиц продуктов независимо от
их квантового состояния. В этом случае р-ция характеризуется макроскопич.
константой скорости, к-рую получают из
представляет интерес полная концентрация частиц продуктов независимо от
их квантового состояния. В этом случае р-ция характеризуется макроскопич.
константой скорости, к-рую получают из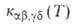 суммированием по конечным состояниям частиц продуктов и усреднением по
начальным состояниям частиц реагентов:
суммированием по конечным состояниям частиц продуктов и усреднением по
начальным состояниям частиц реагентов:
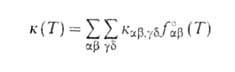
Аналогичным образом м. б. определена любая частично усредненная константа
скорости, к-рая описывает кинетику р-ции при разл. степени детализации
квантовых состояний частиц реагентов и продуктов.
Т. обр., теория Б. р. связывает кинетич. параметр р-ции — константу
скорости к (Т)-с сечением р-ции, т.е. с динамич. характеристикой
парного столкновения молекул. Приближенное значение к (Т) для равновесных
р-ций может быть также рассчитано в рамках теории активированного комплекса,
что позволяет избежать промежут. расчета сечения р-ции и микроскопич. констант
скорости.
Для очень быстрых процессов, напр. горения, процессов в ударных волнах
и плазме, для ряда космохим. р-ций, когда в системе полностью отсутствует
термич. распределение частиц, понятия микроскопич. и макроскопич. констант
скорости р-ции теряют смысл и сечение р-ции становится ее единственной
характеристикой.
Количеств. оценка скорости Б. р. и расчет констант скорости - чрезвычайно
сложная задача, требующая знания ф-ций распределения реагирующих частиц
и частиц продуктов по внутр. степеням свободы. Информация о столкновениях
между отдельными молекулами на предварительно выбранных энергетич. уровнях
стала доступной благодаря использованию молекулярных пучков метода.
Для
экзотермич. р-ций очень важно исследование ф-ции распределения молекул
продуктов по колебательно-вращательным состояниям. Если это распределение
сильно неравновесно, запасенная в молекулах энергия м. б. непосредственно
превращена в когерентное электромагн. излучение хим. лазера. Другое практич.
применение сведений о кинетике неравновесных Б. р. связано с возможностью
избирательного увеличения скорости эндотермич. р-ций путем предварительного
перевода молекул реагентов в определенные возбужденные состояния. Е.Е.
Никитин.
Реакции в жидкостях и твердых телах. Частицы, реагирующие друг с другом
в жидкости или в твердом теле, сильно взаимод. с окружением, поэтому ф-ция
распределения их по энергии является, как правило, максвелл-больцмановской,
а кинетика Б. р.-равновесной. Лимитирующая стадия таких р-ций - собственно
хим. взаимод. при контакте реагирующих частиц или диффузионное сближение
частиц. В последнем случае скорость р-ции контролируется диффузией, и энергия
активации р-ции совпадает с энергией активации диффузии. В твердых телах
диффузионное перемещение частиц замедляется настолько, что сближение реакционных
центров осуществляется по недиффузионным механизмам: посредством миграции
своб. валентности -эстафетной передачей атома Н (в радикальных р-циях),
эстафетным переносом протона или электрона, миграцией экситона (в р-циях
электронно-возбужденных частиц). Низкая молекулярная подвижность в конденсированной
фазе обеспечивает также относительно большое время жизни партнеров-частиц
в состоянии контакта и более высокую вероятность р-ции по сравнению с соответствующими
газофазными р-циями (см. Клетки эффект).
Важная особенность Б. р. в жидкостях и твердых телах — сольватация реагентов,
к-рая изменяет реакционную способность и состав реагирующих частиц (напр.,
соотношение своб. и сольватированных радикалов, ионов и ионных пар, молекул
и их ассоциатов и т.д.). Сольватация изменяет скорость, а часто и направление
и механизм Б. р., влияет на выход продуктов и является поэтому эффективным
способом управления р-цией.
===
Исп. литература для статьи «БИМОЛЕКУЛЯРНЫЕ РЕАКЦИИ»: Термические бимолекулярные реакции в газах, М., 1976; Энтелис
С. Г., Тигер Р. П., Кинетика реакций в жидкой фазе, М.. 1973. А. Л.
Бучаченко.
Страница «БИМОЛЕКУЛЯРНЫЕ РЕАКЦИИ» подготовлена по материалам химической энциклопедии.
|

