|
БОРА ТРИХЛОРИД ВС13, бесцв.
газ, дымящий во влажном воздухе; т. пл. —107,3°С, т. кип. 12,6°С; плотн. 1,343
г/см5 (11°С); tкрит 178,8 °С; ур-ние температурной зависимости
давления пара: Ig p (мм рт. ст.) = 2115Т-1 - 7 041g T+ 27,56 (186-285,5
К); С° 62,65 Дж/(моль*К);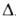 Hoисп 23,86 кДж/моль,
Hoисп 23,86 кДж/моль,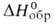 -404,5 кДж/моль; S°298 289,35 Дж/(моль*К). Молекула плоская,
длина связи В—С1 1,73 нм. Б.т. раств. в СС14, СНС13, TiCl4,
SiCl4. Гидролизуется водой до Н3ВО3; восстанавливается
Н2 при ~ 800°С до В, при 450°С в присут. катализатора (Сu—А1) - до
В2Н6. Фтор полностью вытесняет хлор из молекулы ВС13,
при взаимод. ВС13 с бромидами или иодидами В при ~ 20°С довольно
быстро образуются смешанные галогениды. ВС13 - к-та Льюиса, образует
аддукты с эфирами, аминами, хлоридами др. элементов, нек-рыми гидридами и др.
Спирты реагируют с ВС13 с образованием эфиров - боратов B(OR)3.
-404,5 кДж/моль; S°298 289,35 Дж/(моль*К). Молекула плоская,
длина связи В—С1 1,73 нм. Б.т. раств. в СС14, СНС13, TiCl4,
SiCl4. Гидролизуется водой до Н3ВО3; восстанавливается
Н2 при ~ 800°С до В, при 450°С в присут. катализатора (Сu—А1) - до
В2Н6. Фтор полностью вытесняет хлор из молекулы ВС13,
при взаимод. ВС13 с бромидами или иодидами В при ~ 20°С довольно
быстро образуются смешанные галогениды. ВС13 - к-та Льюиса, образует
аддукты с эфирами, аминами, хлоридами др. элементов, нек-рыми гидридами и др.
Спирты реагируют с ВС13 с образованием эфиров - боратов B(OR)3.
Получают ВС13: хлорированием В, его сплавов (напр., ферробора)
при ~ 1000°С или раскаленной смеси В2О3 (или Na2B4O7)
с углем; взаимод. А1С13 с BF3 или K[BF4].
Используют ВС13 для получения В высокой чистоты, В2Н6,
борорг. и др. соед. В, как катализатор катионной полимеризации, реагент
для удаления нитридов, карбидов и оксидов из расплавов Al, Mg, Zn, Cu.
При действии электрич. разряда на ВС13 получены низшие хлориды
- В2С14, В4С14 и В8С18.
===
Исп. литература для статьи «БОРА ТРИХЛОРИД»: Фурман А. А., Неорганические хлориды, М,, 1980, с. 128-42.
А. Е. Виноградов.
Страница «БОРА ТРИХЛОРИД» подготовлена по материалам химической энциклопедии.
|

