|
БОРАТЫ НЕОРГАНИЧЕСКИЕ (оксобораты), соли борных к-т: метаборной
НВО2, ортоборной Н3ВО3 и не выделенных
в своб. состоянии полиборных Н3m-2nВmO3m-n.
По числу атомов бора в молекуле делятся на моно-, ди-, тетра-, гексабораты
и т.д. Бораты (Б.) называют также по образующим их к-там и по числу молей
В2О3, приходящемуся на 1 моль основного оксида. Так,
разл. метабораты м. б. названы моноборатами, если содержат анион В(ОН)4
или цепочечный анион {BO2}nn-, диборатами
- если _содержат цепочечный сдвоенный анион {В2О3(ОН)2}n2n-,
триборатами - если содержат кольцевой анион (В3О)63-.
Структуры Б. включают борокислородные группировки - "блоки", содержащие
от 1 до 6, а иногда и 9 атомов В, напр.:
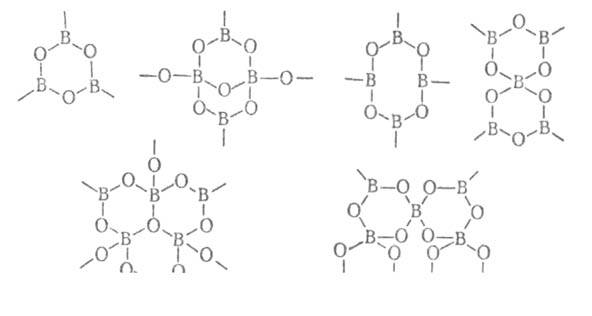
Координационное число атомов В 3 (борокислородные треугольные группировки)
или 4 (тетраэдрич. группировки). Борокислородные группировки - основа не
только островных, но и более сложных структур - цепочечных, слоистых и
каркасных полимеризованных. Последние образуются в результате отщепления
воды в молекулах гидратированных Б. и возникновения мостиковых связей через
атомы О; процесс иногда сопровождается разрывом связей В—О внутри полианионов.
Полианионы могут присоединять боковые группы - борокислородные тетраэдры
или треугольники, их димеры или посторонние анионы.
Аммоний, щелочные, а также и другие металлы в степени окисления + 1
образуют чаще всего гидратированные и безводные метабораты типа МВО2,
тетрабораты М2В4О7, пентабораты МВ5О8,
а также декабораты М4В10О17*nН2О.
Щел.-зем. и др. металлы в степени окисления +2 дают обычно гидратированные
метабораты, трибораты М2В6ОП и гексабораты
МВ6О10, а также безводные мета-, орто- и тетрабораты.
Для металлов в степени окисления + 3 характерны гидратированные и безводные
ортобораты МВО3. Известно большое число смешанных Б., напр.
октабораты М2IМIIВ8О11*nН2О,
а также Б. с включением др. анионов - гетерополибораты, из к-рых наиб.
важны соед. типа борацита М3II(В7O13)Х
(Х - галоген, ОН, NO2- и др.).
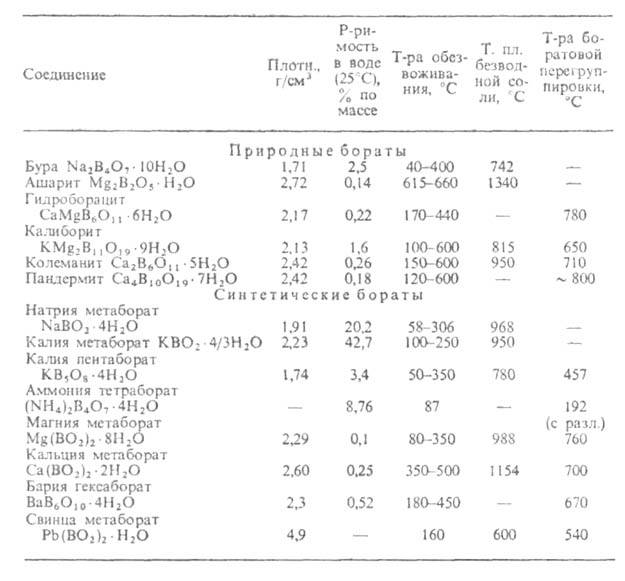
Б.-бесцв. аморфные в-ва или кристаллы (в осн. с низкосимметричной структурой
- моноклинной или ромбической). Для безводных Б. т-ры плавления находятся
в интервале от 500 до 2000°С; наиб. высокоплавки метабораты щелочных и
орто- и метабораты щел.-зем. металлов (см. табл.). Большинство Б. при охлаждении
их расплавов легко образует стекла. Твердость гидратированных Б. по шкале
Мооса 2-5, безводных - до 9.
СВОЙСТВА НЕОРГАНИЧЕСКИХ БОРАТОВ
Гидратированные монобораты теряют кристаллизационную воду до ~180°С,
полибораты - при 300-500°С; отщепление воды за счет групп ОН, координированных
вокруг атомов В, происходит до ~750°С. При полном обезвоживании образуются
аморфные в-ва, к-рые при 500-800 °С в большинстве случаев претерпевают
"боратовую перегруппировку" - кристаллизацию, сопровождающуюся (для полиборатов)
частичным разложением с выделением В2О3.
Б. щелочных металлов, аммония и Т1(1) раств. в воде (особенно мета-
и пентабораты), в водных р-рах гидролизуются (р-ры имеют щелочную р-цию).
Большинство Б. легко разлагается к-тами, в нек-рых случаях - при действии
СО2 и SO2. Бораты щел.-зем. и тяжелых металлов взаимод.
с р-рами щелочей, карбонатов и гидрокарбонатов щелочных металлов. Безводные
Б. химически более стойки, чем гидратированные. С нек-рыми спиртами, в
частности с глицерином, Б. образуют р-римые в воде комплексы. При действии
сильных окислителей, в частности Н2О2, или при электрохим.
окислении Б. превращаются в пероксобораты.
Известно ок. 100 природных Б., являющихся в осн. солями Na, Mg, Ca,
Fe; важнейшие из них приведены в таблице.
Гидратированные Б. получают: нейтрализацией Н3ВО3 оксидами,
гидроксидами или карбонатами металлов; обменными р-циями Б. щелочных металлов,
чаще всего Na, с солями др. металлов; р-цией взаимного превращения малорастворимых
Б. с водными р-рами Б. щелочных металлов; гидротермальными процессами с
использованием галогенидов щелочных металлов в кач-ве минерализующих добавок.
Безводные Б. получают сплавлением или спеканием В2О3
с оксидами или карбонатами металлов или обезвоживанием гидратов; монокристаллы
выращивают в р-рах Б. в расплавл. оксидах, напр. Bi2O3.
Б. используют: для получения др. соед. В; как компоненты шихты при произ-ве
стекол, глазурей, эмалей, керамики; для огнестойких покрытий и пропиток;
как компоненты флюсов для рафинирования, сварки и пайки металлов; в кач-ве
пигментов и наполнителей лакокрасочных материалов; как протравы при крашении,
ингибиторы коррозии, компоненты электролитов, люминофоров и др. Наиб, применение
находят бура (см. Натрия бораты)и кальция бораты. См. также
Борные руды.
Б. малотоксичны. ПДК в питьевой воде 1 мг/л в пересчете на В2О3
(по данным США).
===
Исп. литература для статьи «БОРАТЫ НЕОРГАНИЧЕСКИЕ»: Изучение высокотемпературных боратов, М., 1970; Годе Г.
К., Синтезы боратов, ч. 1-2, Рига, 1971-72; Горбов А. Ф., Геохимия бора,
Л., 1976; Бораты и боратные системы, Рига, 1978; Исследование синтетических
боратов, Рига, 1981; Леонюк Н.И., Леонюк Л.И., Криста.похимия безводных
боратов, М., 1983; Heller G, "Fortschritte chemischen Forschungen", 1970,
Bd 15, H. 2, S. 206-80; Christ С L, Clark J. R., "Physics and Chemistry
of Minerals", 1977, v. 2, N 1-2, p. 59-87. П.И. Федоров.
Страница «БОРАТЫ НЕОРГАНИЧЕСКИЕ» подготовлена по материалам химической энциклопедии.
|

