|
БОРОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ, содержат атом В, связанный с орг.
остатком. Включают: органобораны RnBX3-n(n
=
1-3); нейтральные комплексы RnX3-nB*L (и = 1-3);
органобораты M[RnBX4_n] (n = 1-4); борониевые
соли [R(X)BL2]Y, где Х-Н, Hal, ОН, OR', SeR', NH2,
NR2, NHNHR', SO4 и т.д., М - катион металла, NH4
или др., L - эфир, амин, сульфид, фосфин и др., Y - анион. К Б. с. также
относят соед., содержащие В в цикле (борацикланы), внутрикомплексные соед.
и органокарбораны (см. Карбораны). Синтезированы диборные [напр.,
R2B—BR2, R2BNHNHBR2, C6H4(BR2)2]
и полиборные соединения. Во всех этих в-вах координационное число бора
3 или 4. Наиб. изучены алкил-, ци-клоалкил-, арил-, алкенил- и аллилбораны,
а также борацикланы.
В органоборанах атом В и три связанных с ним атома лежат в одной плоскости,
а вакантная 2р-орбиталь перпендикулярна к ней; углы RBX близки к 120° (исключение-1-бораадамантан).
Трифенил-, три(1-нафтил)-, тримезитилборан и их гомологи в твердом состоянии
и в р-рах при низких т-рах имеют конформацию трехлопастного пропеллера.
Производные четырехкоординированного В имеют строение правильного или искаженного
тетраэдра.
Большинство органоборанов мономерны; нек-рые ассоциированы за счет межмол.
координации [как, напр., в (R2BONH2)2],
трехцентровых двухэлектронных [напр., в (R2BH2)2]
или водородных связей.
Молекулы бороксолов (RBO)3, боразолов (RBNR')3
и
сосд. типа (RBS)3 представляют собой шестичленные циклы.
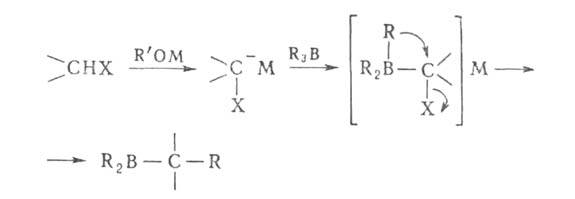
Органобораны - к-ты Льюиса; с основаниями (NH3, R'M, R'OM)
дают комплексные соед., напр. (C2H5)3B*NH3,
и органобораты, напр. М [R3BC CR'],
M [R3BCN]. Комплексообразование с аминами используется для количеств.
оценки стерич. напряжений. CR'],
M [R3BCN]. Комплексообразование с аминами используется для количеств.
оценки стерич. напряжений.
При изучении Б. с. широко применяется спектроскопия ЯМР 11В,
поскольку величины хим. сдвигов 11В определяются строением и
числом заместителей при атоме В. Связь В—С ковалентная, слабополярная.
Органобораны RBX2 не способны диссоциировать с образованием
карбаннонов (в отличие от солей последних).
Длина связи В—С уменьшается в ряду В—Сsp3 > В—Csp2
> В—Сsр, а также при уменьшении координационного числа бора.
Напр., длины связей В—С (нм) составляют: для (СН3)3В
0,15783, для (CH3)2BF 0,155, для (С6Н5)3В
0,152, для НС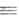 CBF2
0,1513; для (CH3)3B*N(CH3)3
0,165, для (С6Н5)4В- 0,164-0,169. CBF2
0,1513; для (CH3)3B*N(CH3)3
0,165, для (С6Н5)4В- 0,164-0,169.
Энергия (Е)связи В—С в триалкилборанах (342-368 кДж/моль) близка
к энергии связи С—С в алканах (355-368 кДж/моль). Связи В—Сsр2
прочнее связей В—Csp3. Напр., в (СН3)3В
Е
= 363 кДж/моль, в CH3BF2 400 кДж/моль, в (С6Н5)2ВВг
460 кДж/моль.
По хим. св-вам Б. с. отличаются от орг. соед. Li, Mg, Al и др. металлов.
Так, алкил- и арилбораны не реагируют с СО2, орг. галогенидами,
эпоксидами, производными карбоновых к-т и т.д. Триалкилбораны, трициклоалкилбораны
и алифатич. борацикланы не расщепляются водой, спиртами, аминами, кетонами
и сложными эфирами, р-рами неорг. к-т и щелочей до 100-130°С. Это позволяет
проводить многие р-ции Б. с. в водных и спиртовых р-рах. Однако в гидридах
(R2BH)2 и (RBH2)2 связи В—Н
легко расщепляются водой и спиртами.
Низшие члены рядов R3B, R2BX, а также борацикланы
самовоспламеняются на воздухе (по зеленому цвету пламени судят о наличии
В в соед.). Четырехкоординационные соед. В, как правило, устойчивы на воздухе.
Триарилбораны с Na или его амальгамой дают ярко-окрашенные анион-радикалы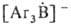 или
или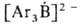 ;
R2BHal(R=Alk, Ar) с К или Na-радикалы R2B, к-рые
стабилизируются основаниями, напр. пиридином. ;
R2BHal(R=Alk, Ar) с К или Na-радикалы R2B, к-рые
стабилизируются основаниями, напр. пиридином.
Б. с. легко окисляются Н2О2 в щелочной среде,
СrO3, КМnО4 и др. При гидролизе или ацидолизе органоборанов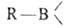 всегда образуются RH и
всегда образуются RH и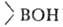 (или
(или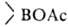 );
р-ции экзотермичны, т.к. связь В—О очень прочна. );
р-ции экзотермичны, т.к. связь В—О очень прочна.
В большинстве Б. с. борсодержащую группу можно заменить практически
на любую функц. группу, Н, D, металл, орг. остаток и т.д., напр.:
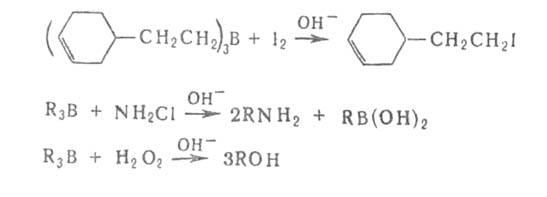
Разработаны также способы наращивания углеродной цепи при атоме бора
на любое число атомов С с одновременным введением функц. группы. Органобораны
электрофильны, а органобораты нуклеофильны. Первая стадия большинства р-ций
органоборанов - образование комплексов типа R3B*L или боратов
Р-ции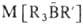 Б.с.
можно разделить на след. типы: Б.с.
можно разделить на след. типы:
1. Обмен функц. групп при атоме В, напр.:
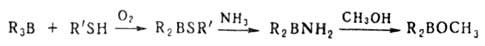 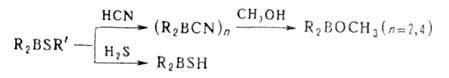
2. Электрофильное деборирование, включает протолиз, галодеборирование
арилборанов, взаимод. с солями нек-рых металлов и обменные р-ции.
Протолиз Б.с. реагентами НХ (Н2О, ROH, RCOOH,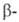 дикетоны, R2NH и др.) широко используется для получения разл.
типов Б. с., защиты и определения ОН- и NH2-групп, обезвоживания
кристаллогидратов, в акваметрии. Протолиз - промежут. стадия разл. р-ций,
в частности "цис-гидрирования" ацетиленов, олефинов и др. непредельных
соед.:
дикетоны, R2NH и др.) широко используется для получения разл.
типов Б. с., защиты и определения ОН- и NH2-групп, обезвоживания
кристаллогидратов, в акваметрии. Протолиз - промежут. стадия разл. р-ций,
в частности "цис-гидрирования" ацетиленов, олефинов и др. непредельных
соед.:
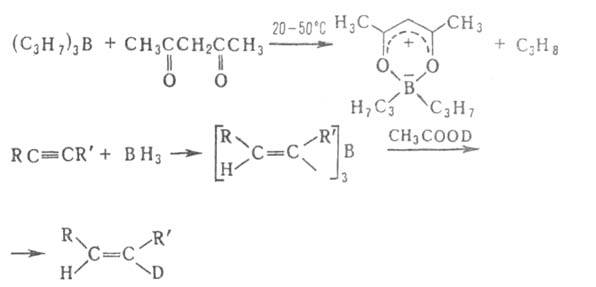
Триалкилбораны и алифатич. борацикланы реагируют с Н2О, ROH,
R2NH,. H2S, щелочами и неорг. к-тами при 150-200
°С с разрывом одной связи В—С; при этом образуются R2BX, RH,
H2 и олефин.
В присут. каталитич. кол-в меркаптанов (и следов О2) или
(СН3)3ССООН т-ра р-ции м. б. снижена до 20-70°С Многие
Б. с. расщепляются карбоновыми к-тами с образованием углеводородов (при
этом конфигурация атома С в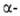 положении
не меняется): R3B + R'COOH -> 3RH. положении
не меняется): R3B + R'COOH -> 3RH.
Алкинилбораны расщепляются водой и спиртами при 0°С, арил- и винилбораны
- водой, спиртами и карбоновыми к-тами при 20-80°С (исключение - тримезитилборан),
напр.:
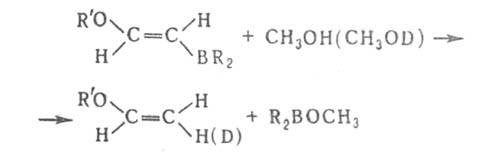
Протолиз бензил- и аллилборанов осуществляется с перегруппировкой:
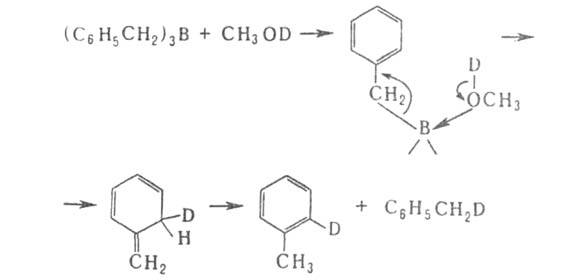
Арилбораны взаимод. с галогенами с образованием арилгалогенидов.
Типичные р-ции электроф. замещения - переметаллирование, используются
для получения металлоорганич. соед., напр.:
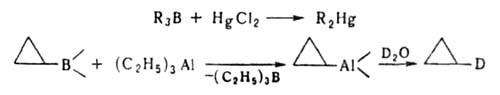
Только с использованием соответствующих Б. с. получены органические
производные Ag и Си, напр. 1-(2-хлорферроценил)серебро, циклопентадиенилмарганецтрикарбонилмедь.
Обменные р-ции органоборанов (диспропорционирование и симметризация)
катализируются соед., содержащими группу В—Н, напр.:
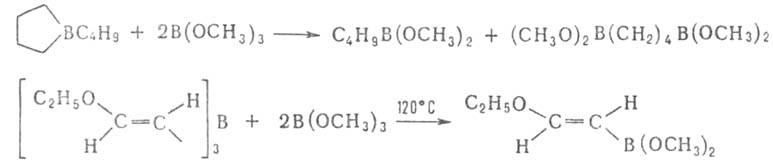
Присоединение к кратным связям не характерно для Б. с. Известно лишь
неск. примеров таких р-ций, напр. присоединение трибензилборана к алкоксиацетиленам
(протекает с перегруппировкой):
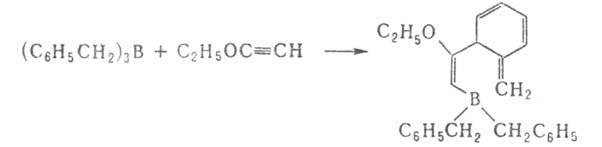
При р-циях Alk3B с циклопропенами и бициклобутаном образуются
непредельные Б.с.:
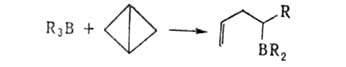
3. 1,2-Анионотропные перегруппировки приводят к образованию новых связей
С—С, С—О, С—S, С—N и т.д.:
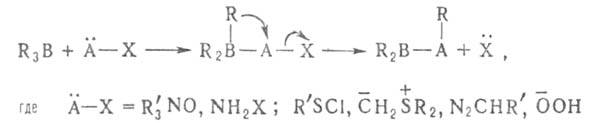
Во всех случаях сохраняется конфигурация R.
К этому типу р-ций относится взаимодействие органоборанов с аминоксидами,
алкилсульфенилгалогенидами, илидами, Н2О2, диазосоединениями,
а также перегруппировки органоборанов, содержащих электроотрицательные
группы у атома С в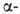 положении
к В, под действием нуклеофилов (R"OH, R"NH2) или электрофилов
(А1С13, ZnCl2): положении
к В, под действием нуклеофилов (R"OH, R"NH2) или электрофилов
(А1С13, ZnCl2):
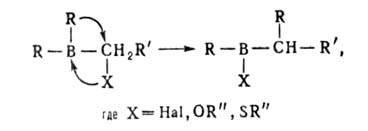
При взаимод. органоборанов R3B и борацикланов с СО (карбонилирование)
мигрируют в зависимости от т-ры одна, две или три группы R:
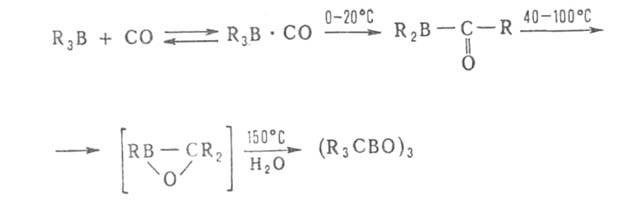
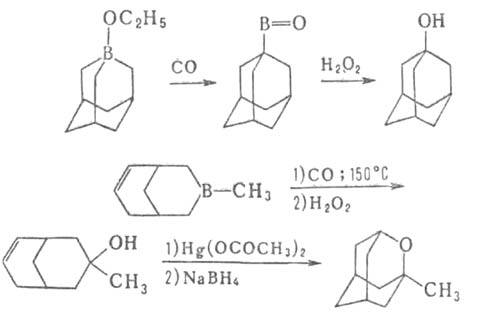
Карбонилирование применяется для синтеза спиртов, альдегидов, карбоновых
к-т, в т.ч. прир. в-в, напр. ювабиона, а также циклич. и каркасных соед.,
напр.:
Мн. органобораты устойчивы в обычных условиях, но перегруппировываются
под действием электроф. реагентов Е—У по схеме:
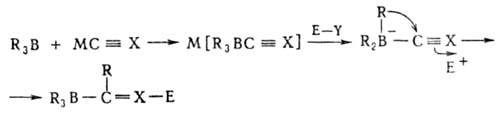
где МС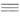 Х
= МС Х
= МС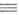 CR', MC CR', MC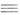 N,
MCH=CR2', MAr; М = = Li, Na, К; Е—Y = НС1, СH3I,
(CH3)2SO4, (C2H5)3OBF4,
CH2=CHCH2Br, CH3COC1 и др. N,
MCH=CR2', MAr; М = = Li, Na, К; Е—Y = НС1, СH3I,
(CH3)2SO4, (C2H5)3OBF4,
CH2=CHCH2Br, CH3COC1 и др.
Примеры - получение замещенных кетонов и дизамещенных ацетиленов, диалкилирование
ароматических соед.,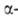 алкилирование тиофена, N-метилиндолов и фурана, напр.:
алкилирование тиофена, N-метилиндолов и фурана, напр.:
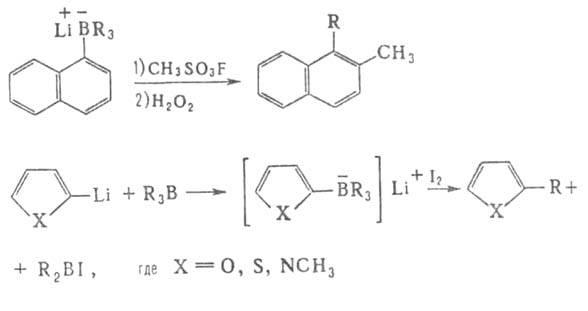
Р-ция R3B с изонитрилами приводит к 2,5-диборадигидропиразинам
(при 150°С), к-рые при нагр. до 200°С (или в присут. протонных р-рителей)
изомеризуются в 2,5-диборапиперазины, что применяется для получения кетонов
и третичных спиртов.
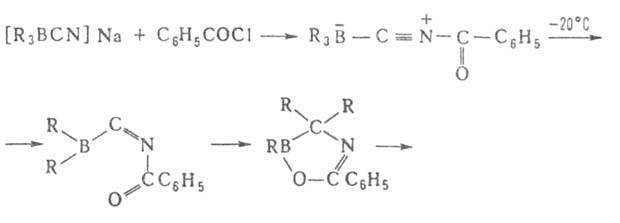
Триорганоцианобораты [R3BCN]-Na+, образующиеся
при взаимодействии R3B и NaCN в воде или диглиме, устойчивы
в обычных условиях, но перегруппировываются под действием HCN, (CF3CO)2O
и С6Н5СОС1. Из образующихся при этом 1-окса-4-аза-2-борациклоент-4-енов
получают амины, кетоны или третичные спирты:
 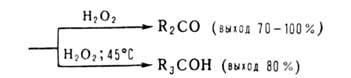
4. Радикальные р-ции, первая стадия к-рых - гомолитич. разрыв связи
В—С Включают: автоокисление (применяется в синтезе пероксидов, спиртов,
гидропероксидов, полимеров); сдваивание радикалов под действием солей Ag,
Cu, Au, Pt, Pd (при получении углеводородов и их производных, металлоорганич.
соед.); инициируемое О2, УФ-излучением или пероксидами 1,4-присоединение
R3B к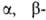 непредельным альдегидам и кетонам; деалкилирование триалкилборанов меркаптанами,
диалкилдисульфидами; алкилирование нек-рых олефинов, ароматич. и гетероциклич.
соед.:
непредельным альдегидам и кетонам; деалкилирование триалкилборанов меркаптанами,
диалкилдисульфидами; алкилирование нек-рых олефинов, ароматич. и гетероциклич.
соед.:
Эфиры акриловой и метакриловой к-т, их нитрилы и др. мономеры полимеризуются
под действием органоборанов и следов О2 по цепному радикальному
механизму.
5. Р-ции с участием Н
и Н
и Н, т.е.
атомов Н соотв. в Н, т.е.
атомов Н соотв. в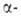 или или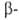 положении
к атому В. При галогенировании алкилборанов замещается атом положении
к атому В. При галогенировании алкилборанов замещается атом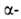 Н
и образуются Н
и образуются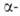 галогеналкилбораны. Последние расщепляются выделившимся HHal, давая RHal,
а под действием Н2О, аминов или А1На13 перегруппировываются
с образованием новой связи С—С, напр.:
галогеналкилбораны. Последние расщепляются выделившимся HHal, давая RHal,
а под действием Н2О, аминов или А1На13 перегруппировываются
с образованием новой связи С—С, напр.:
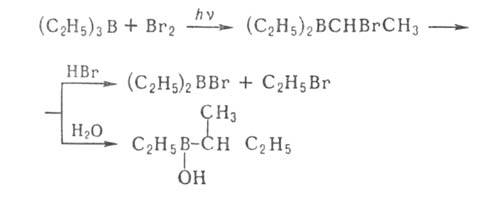
Отщепление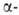 Н
в виде гидрид-иона - основная стадия р-ций органоборатов с галогенсодержащими
орг. соед. (С6Н5СН2С1, RCOC1 и др.): Н
в виде гидрид-иона - основная стадия р-ций органоборатов с галогенсодержащими
орг. соед. (С6Н5СН2С1, RCOC1 и др.):
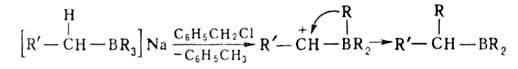
Р-ции алкил- и циклоалкилборанов с участием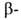 Н:
переалкилирование высшими олефинами, диенами, ацетиленами, восстановление
нитрилов, ароматич. альдегидов и т.д., напр.: Н:
переалкилирование высшими олефинами, диенами, ацетиленами, восстановление
нитрилов, ароматич. альдегидов и т.д., напр.:
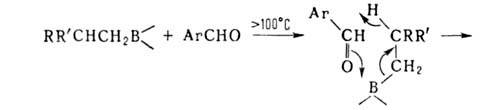 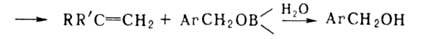
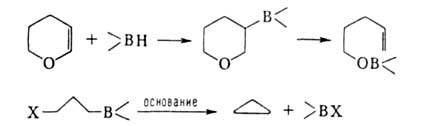
Отрыв лежит в основе синтеза олефинов из нек-рых органоборатов:
лежит в основе синтеза олефинов из нек-рых органоборатов:
Б. с., содержащие электроотрицат. группы X (Hal, OR, SR) в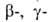 или
или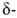 положениях
к атому В, легко претерпевают элиминирование: положениях
к атому В, легко претерпевают элиминирование:
6. Термич. изомеризация, т.е. миграция В в конец углеродной цепи - уникальное
св-во алкил- и циклоалкилборанов:
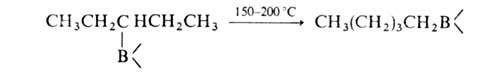
(Кат. - соед., содержащие группу В—Н.) Эта р-ция используется для изомеризации
неконцевых олефинов в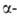 олефины,
метилцикленов в метиленцикланы, для синтеза первичных спиртов и т.п., напр.: олефины,
метилцикленов в метиленцикланы, для синтеза первичных спиртов и т.п., напр.:
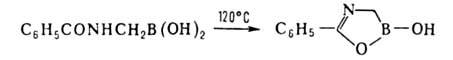
7. Преобразование заместителей при атоме В, т.е. их гидрирование, галогенирование,
нитрование, циклизация и др. Один из примеров - циклизация бензоиламиномегилборной
к-ты:
Бромированием, нитрованием, окислением и т.д. фенил-и толилборной к-т
синтезированы многочисл. функциональные производные фенилборной к-ты. Группы
В(ОН)2 и ВС12 ориентируют замещение в бензольном
кольце в мета-положение, напр. для В(ОН)2 константы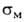 и и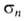 заместителя соотв. -0,01 и +0,013.
заместителя соотв. -0,01 и +0,013.
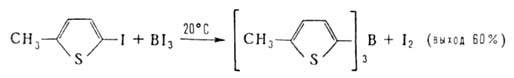
Наиб. распространенные способы получения Б.с.: 1. Переметаллирование
- действие орг. соед. Li, Na, Mg, А1 и др. металлов (М) на ВХ3,
RBX2, R2BX (X = Н, Hal, OR', SR', NR'), напр.:
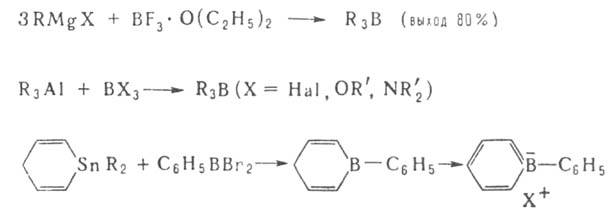
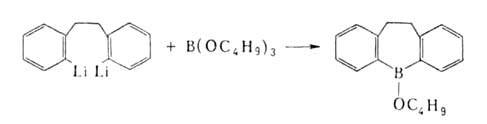
2. Окислит-восстановит. р-ция ВНа13 с АгН или Arl:
3. Гидроборирование, а также аллил-, карбо-, тио- или галоборирование
олефинов, диенов, ацетиленов, алленов и циклопропанов:
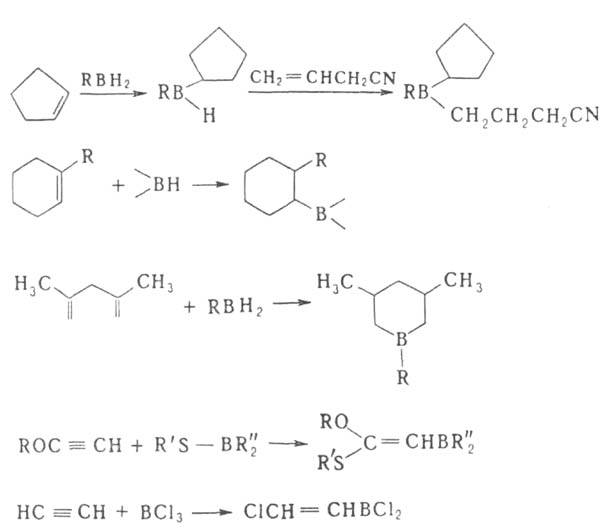
Гидроборирование-цис-присоединение в-в, содержащих группу ВН, к кратной
связи. Гидроборирующими агентами служат диборан (в эфирах), комплексы борана
с ТГФ, аминами, диметилсульфидом, а также получаемые из Н3В*ТГФ
дициклогексилборан, бис-(1,2-диметилпропил)боран (так наз. дисиамилборан),
1,1,2-триметилпропилборан (тексилборан), катехолборан (ф-ла I); 9-борабицикло-[З.З.Пнонан
(9-ББН; II), а также диизопинокам-феилооран(III)-один из широко распространенных
хиральных реагентов в орг. химии.
4. Обменные р-ции, катализируемые соед., содержащими группу В—Н, напр.:
R3B + BX3 -> R2BX+ RBX2, где
X = Hal, OR', SR', NR2 и др.
5. Переалкилирование триалкилборанов высшими олефинами, ацетиленами
или диенами (при 150-200°С):
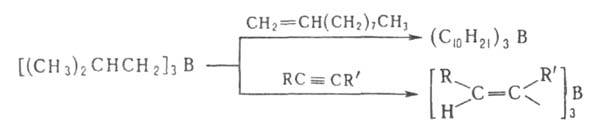
6. Пиролиз алкил- или арилборанов, Триалкилбораны, имеющие хотя бы в
одном из заместителей больше трех атомов С, при 200-300 °С превращаются
в борацикланы (с промежуточным образованием диалкилборанов и соответствующих
олефинов), напр.:
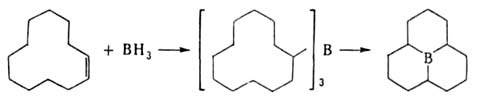
7. Диборирование олефинов, ацетиленов, циклопропанов и ароматич. соед.
производными диборана, напр.:
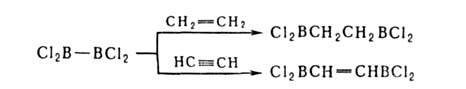
8. Деалкилирование или деарилирование оргатюборанов, напр. при их взаимод.
с галогенами и неорг. к-тами (см. выше).
Б. с. широко применяются в орг. синтезе. Органобораны алкилируют, арилируют
и винилируют галоформы, тио-соед. и галогенкарбонильные
соед. в присут. оснований, генерирующих карбанион. Последний реагирует
с органобораном с образованием галогенкарбонильные
соед. в присут. оснований, генерирующих карбанион. Последний реагирует
с органобораном с образованием галоген-
или галоген-
или тиоалкилсодержащего
Б. с., претерпевающего 1,2-анионотропную перегруппировку: тиоалкилсодержащего
Б. с., претерпевающего 1,2-анионотропную перегруппировку:
Эти р-ции применяются в синтезе вторичных и третичных спиртов, альдегидов
и кетонов.
Эфиры галогенуксусной
к-ты и галогенуксусной
к-ты и бромметилсульфонильные
эфиры алкилируются и арилируются в присут. (СН3)3СОК, бромметилсульфонильные
эфиры алкилируются и арилируются в присут. (СН3)3СОК, галогеннитрилы
- в присут. 2,6-ди-трет-бутилфенолята К: галогеннитрилы
- в присут. 2,6-ди-трет-бутилфенолята К:
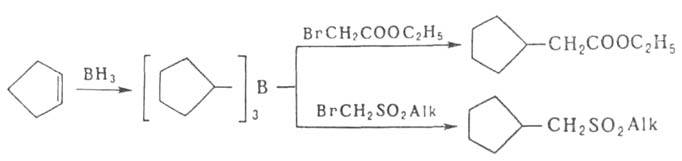
Используются также органобораты меди Cu[R3BCH3]
и комплексы RCu*BF3, в частности, для алкилирования алкилирования непредельных альдегидов и кетонов, производных акриловой и пропиоловой
(ацетиленкарбоновой) к-т.
непредельных альдегидов и кетонов, производных акриловой и пропиоловой
(ацетиленкарбоновой) к-т.
В ряде случаев R3B (R-Alk, циклоалкил) применяются для повышения
селективности р-ций, напр.:
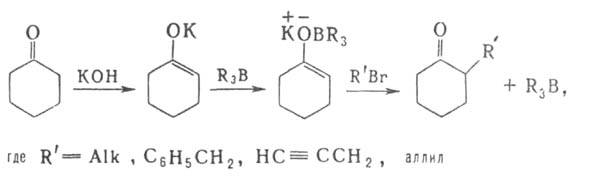
Производные диборана (R2BH)2, (RBH2)2,
их комплексы R2BH*L, RBH2*L [где R-Alk, Ar, OR',
SR', Hal; L-диэтиловый эфир, ТГФ, (CH3)2S, R3N,
пиридин и др.], а также органогидробораты M[R3BH] (R = Н, Alk,
C6H5, мезитил;
К2В - борациклоалкил; К3В - борафеналил и др.)
- селективные восстановители функциональных групп и кратных связей. Соединения
типа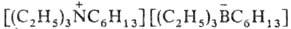 (обозначается
N2226B2226) - апроточные высокополярные р-рители. (обозначается
N2226B2226) - апроточные высокополярные р-рители.
Применяют Б. с. также для получения бороводородов и карборанов; как
добавки к моторным и реактивным топливам, смазочным маслам и красителям;
как катализаторы и сокатализаторы полимеризации непредельных соед. и окисления
углеводородов; антиоксиданты, бактерициды, фунгициды; реагенты в хим. анализе,
напр. калигност NaB(C6H5)4 и цезигност
Na[(С6Н5)3ВСК] - для определения и выделения
К+ , Rb+ , Cs+ , NH4+,
аминов и антибиотиков; флавогност (С6Н5)2ВОСН2СН2NН2
-
для определения, идентификации и характеристики флавонов и выделения антибиотиков.
Некоторые Б. с. используют в медицине, в частности для нейтронной терапии
раковых опухолей.
===
Исп. литература для статьи «БОРОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ»: Михайлов Б. М., Бубнов Ю. Н., Борорганические соединения
в органическом синтезе, М., 1977; Пел тер А., Смит К., в кн.: Общая органическая
химия, пер. с англ., т. 6, ч. 14, М., 1984, с. 233-537; KliegelW., Вог
in Biologic, Medizin und Pharmazic, B.-[u. a.], 1980. Ю. Н. Бубнов.
Страница «БОРОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ» подготовлена по материалам химической энциклопедии.
|

