|
ВОДОРОД
НВr, бесцв. газ с резким запахом, сильно дымящий на воздухе; т. пл. — 86,91°С,
т. кип. -66,7°С; плотн. жидкого НВг 2,17 г/см3 (-68°С);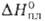 2,3 кДж/моль,
2,3 кДж/моль,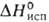 17,61
кДж/моль, - 34,1 кДж/моль; S°298 198,6 Дж/(моль*К); tкрит
90,0°С, 17,61
кДж/моль, - 34,1 кДж/моль; S°298 198,6 Дж/(моль*К); tкрит
90,0°С,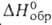 ркрит
8,54 МПа; давление пара (в МПа): 1,73 (12оС)2,41 (26°С),
4,07 (50°С). 7ермически устойчив: степень диссоциации при 1000°С 0,5%, при 1220
°С 1,1%. Связь Н—Вr полярна, дипольный момент 0,79*10-30 Кл*м. Р-римость
(г в 100 г воды): 221 (0°С), 193 (25 °С), 130 (100°С). Для азеотропной смеси
(47,63% НВг) т. кип. 124,3 °С. ркрит
8,54 МПа; давление пара (в МПа): 1,73 (12оС)2,41 (26°С),
4,07 (50°С). 7ермически устойчив: степень диссоциации при 1000°С 0,5%, при 1220
°С 1,1%. Связь Н—Вr полярна, дипольный момент 0,79*10-30 Кл*м. Р-римость
(г в 100 г воды): 221 (0°С), 193 (25 °С), 130 (100°С). Для азеотропной смеси
(47,63% НВг) т. кип. 124,3 °С.
Водный р-р НВг (бромистоводородная к-та) - одна из самых сильных к-т
(рКo - 9; в р-ре НВr полностью диссоциирован); d420
для р-ров разл. концентрации: 1,0723 (10%), 1,2580 (30%), 1,5173 (50%),
1,7675 (65%). Сильный восстановитель, медленно окисляется, выделяя Вr2
даже при стоянии на воздухе; образует соли - бромиды. НВг получают: взаимод.
паров Вr2 с Н2 при 500-550°С в присут. платинированного
асбеста; как побочный продукт при синтезе бромпроизводных орг. соед.; взаимод.
Вr2 с SO2 или S в присут. воды.
Б. в. и бромистоводородную к-ту используют для получения бромпроизводных
орг. и неорг. соед., а Б. в. также как катализатор орг. р-ций. Б. в. токсичен,
при попадании на кожу вызывает зуд и воспаление. ПДК 10 мг/м3.
===
Исп. литература для статьи «ВОДОРОД»: нет данных
Страница «ВОДОРОД» подготовлена по материалам химической энциклопедии.
|

